Kann Enhertu Eierstockkrebs behandeln? Alle Daten, kein Hype.
Zuletzt aktualisiert: 15. Juli 2024
Sie können legal Zugang zu neuen Arzneimitteln erhalten, auch wenn diese in Ihrem Land nicht zugelassen sind.
Erfahren Sie, wieEnhertu (fam-trastuzumab deruxtecan-nxki) wurde von der FDA erstmals im Jahr 2019 1 zugelassen. Zu diesem Zeitpunkt war es für die Behandlung von HER2-positivem Brustkrebs zugelassen. Seitdem ist Enhertu für weitere Indikationen zugelassen worden. Dazu gehören HER2-positiver Magenkrebs, HER2-armer Brustkrebs und HER2-mutierter nicht-kleinzelliger Lungenkrebs. Seit April 2024 ist die Behandlung auch für den Einsatz bei allen HER2-positiven Tumoren von der FDA zugelassen5.
In diesem Zusammenhang hat Enhertu in den Medien viel Aufmerksamkeit erregt. Als natürliche Folge des Hypes fragen sich Krebspatienten überall, ob Enhertu auch für sie anwendbar ist.
Wie immer sind wir hier, um das Rauschen zu durchbrechen und die verfügbaren Daten zu prüfen. In diesem Artikel geben wir einen Überblick über alles, was es über Enhertu zu Eierstockkrebs zu wissen gibt.
Welche Art von Krebs wird mit Enhertu behandelt?
Patienten in aller Welt haben sich gefragt, ob Enhertu alle Krebsarten heilen kann. Leider ist das nicht der Fall. Und das ist auch nicht so gewollt. Enhertu ist eine gezielte Therapie speziell für:
- Tumore mit einer HER-2-Expression. HER-2 ist ein Protein, das sich auf der Oberfläche verschiedener Zelltypen im Körper befindet. Es trägt zum normalen Zellwachstum bei. Bei bestimmten Krebsarten kann es jedoch aufgrund von Genveränderungen oder Mutationen überaktiv werden. Die Überexpression von HER2 betrifft zwischen 2 % und 66 % der Fälle von Eierstockkrebs 5.
- Tumore, die sich auf andere Teile des Körpers ausgebreitet haben und/oder inoperabel sind 4. Künftige klinische Studien könnten Enhertu in früheren Stadien der Krebsbehandlung einbeziehen 6. Dies ist jedoch derzeit nicht der Fall.
Wie wirksam ist Enhertu bei Eierstockkrebs?
Die laufende Phase-2-Studie DESTINY-PanTumor02 konzentriert sich auf die Prüfung der Aktivität von Enhertu bei verschiedenen HER2-positiven soliden Krebsarten. Eine dieser Krebsarten ist Eierstockkrebs. Die Zwischenergebnisse der Studie wurden im Juni 2023 veröffentlicht und sind vielversprechend.
Für Patientinnen mit Eierstockkrebs sind die wichtigsten vorläufigen Ergebnisse der Studie:
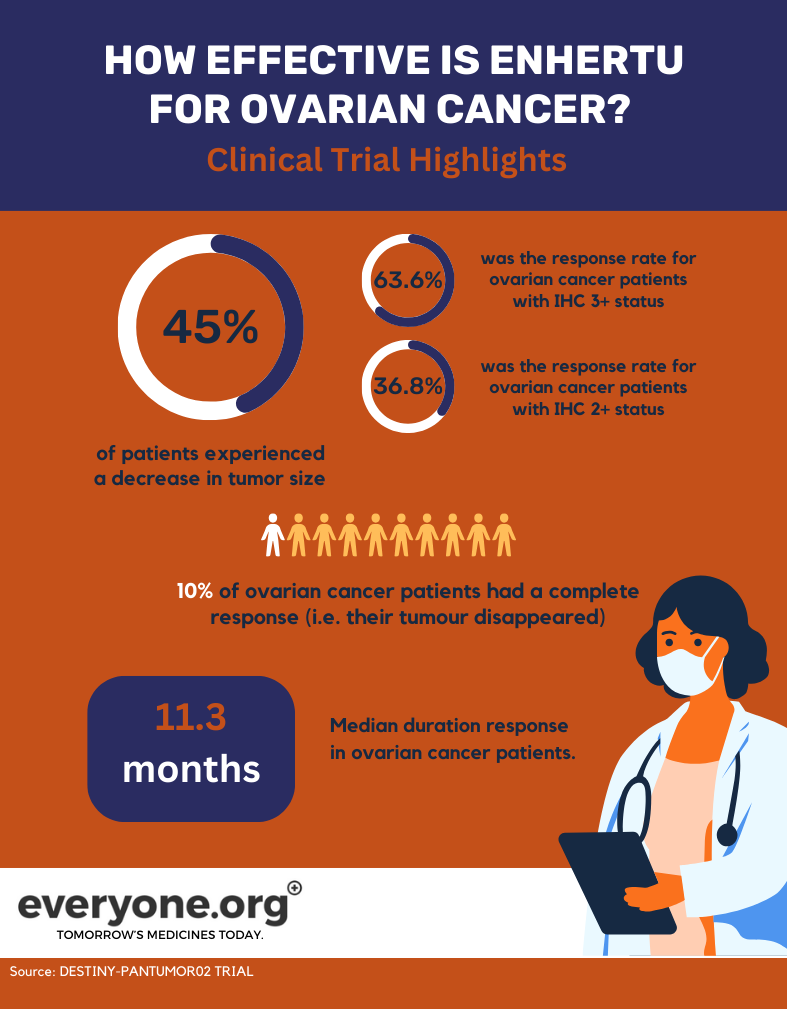
- Die Gesamtansprechrate betrug 45,0 %. Das bedeutet, dass bei 45 % der mit Enhertu behandelten Patientinnen der Tumor schrumpfte. Bei Patienten mit einem HER2-Status von IHC 3+ lag die Gesamtansprechrate bei 63,6 %. Bei Patientinnen mit einem IHC-2+-Status lag die Ansprechrate bei 36,8 % 3.
- 10 % der Patientinnen mit Eierstockkrebs hatten ein vollständiges Ansprechen. Mit anderen Worten, ihr Tumor verschwand vollständig 3.
- Nach 12 Monaten berichteten 45,8 % der Eierstockkrebspatientinnen, deren Tumore sich verkleinert hatten oder verschwunden waren, immer noch von diesem Nutzen3.
- Die mediane Dauer des Ansprechens bei Patientinnen mit Eierstockkrebs betrug 11,3 Monate3.
Insgesamt können diese Ergebnisse als ermutigend angesehen werden. Die lange Dauer des Ansprechens ist laut Dr. Meric-Bernstam (Vorsitzende der Abteilung für Krebsforschungstherapeutika am MD Anderson Cancer Center der USA) ein besonders bemerkenswertes Ergebnis 3.
Auf der Grundlage dieser klinischen Studienergebnisse erteilte die FDA in den USA Enhertu erstmals eine Zulassung für ein Medikament, das bei allen Krebsarten mit HER2-Expression eingesetzt werden kann.

Wann wird Enhertu zur Behandlung von Eierstockkrebs zugelassen?
Ab April 2024 ist Enhertu für alle HER2-exprimierenden Krebsarten, einschließlich Eierstockkrebs, zugelassen.
Die DESTINY-PanTumor02-Studie läuft noch, und die endgültigen Ergebnisse werden für April 2027 erwartet 7. Die vorläufigen Ergebnisse der Studie waren jedoch bereits ausreichend für die jüngste Zulassung der FDA für Pan-Tumor.
Wenn Sie Ihren Wohnsitz außerhalb der USA haben, kann der Zulassungsstatus von Enhertu für Eierstockkrebs unterschiedlich sein.
Kann mein Arzt Enhertu bei Eierstockkrebs verschreiben?
Die beste Antwort lautet derzeit: vielleicht.
Ab Juli 2024 ist Enhertu nur noch in den USA für die Behandlung von HER2-positivem Eierstockkrebs zugelassen. Aber auch in anderen Ländern ist Ihr Arzt befugt, das Arzneimittel für diese Indikation zu verschreiben. Er könnte dies auf der Grundlage der vorläufigen Ergebnisse der klinischen Studie DESTINY-PanTumor02 und der Besonderheiten Ihres Falls tun.
Wenn ein Arzt ein Medikament zur Behandlung einer Krankheit verschreibt, für die es (noch) nicht zugelassen ist, spricht man von Off-Label-Use. Ein Off-Label-Use-Rezept kann in einigen Ländern schwierig auszustellen sein, je nach den örtlichen Vorschriften und der Verfügbarkeit. Es ist jedoch immer möglich, ein solches Rezept im Rahmen der Named-Patient-Import-Verordnung auszustellen.
Hat Ihr Arzt die Entscheidung getroffen, Enhertu für die Behandlung Ihres Eierstockkrebses zu verschreiben? Unser Team auf www.everyone.org kann Ihnen helfen, Zugang zu diesem Medikament zu erhalten. Wir sind auf die Beschaffung und Lieferung von verschriebenen Medikamenten spezialisiert, die im Land des Patienten nicht zugelassen oder nicht erhältlich sind. Kontaktieren Sie uns, damit wir Ihnen helfen können.
Referenzen:
- Stewart, Judith. Enhertu (fam-trastuzumab deruxtecan-nxki) Geschichte der FDA-Zulassung. Drugs.com, 15. August 2022.
- Bahnbrechende Therapie. FDA, 4. Januar 2018.
- Doherty, Kyle. Enhertu Ist vielversprechend für schwer zu behandelnde solide Krebsarten. Cure Today, 6. Juni 2023.
- USPI-DB-04 CDX Update FINAL. Daiichi Sankyo Zugriff am 3. Oktober 2023.
- Teplinsky, Eleonora, und Franco Muggia. EGFR and HER2: is there a role in ovarian cancer?, Translational Cancer Research, 13. Februar 2015.
- Liu, Angus. ASCO: Enhertu liefert "sehr überzeugende" Pan-Tumor-Aktivität. Fierce Pharma, 5. Juni 2023.
- A Phase 2 Study of T-DXd in Patients With Selected HER2 Expressing Tumors (DPT02), ClinicalTrials.gov, abgerufen am 03. Oktober 2023.