Alles, was Patienten über Aduhelm (Aducanumab) wissen müssen | New Alzheimer's Medicine
Zuletzt aktualisiert: 15. März 2022

Sie können legal Zugang zu neuen Arzneimitteln erhalten, auch wenn diese in Ihrem Land nicht zugelassen sind.
Erfahren Sie, wieArtikel überprüft von Dr. Jan de Witt
Am 7. Juni 2021 erteilte die FDA die Zulassung für Aducanumab (Handelsname "Aduhelm") zur Behandlung der Alzheimer-Krankheit und weckte damit die Hoffnungen von Millionen von Alzheimer-Patienten und ihren Familien auf der ganzen Welt, während Experten ihre Bedenken über diese Entscheidung äußerten.
Aduhelm ist das erste Medikament gegen die Alzheimer-Krankheit, das seit 18 Jahren von der FDA zugelassen wurde. Den veröffentlichten Ergebnissen zufolge ist dieses Medikament in der Lage, das Fortschreiten der Alzheimer-Krankheit selbst zu verlangsamen und nicht nur ihre Symptome zu lindern.
Die Entscheidung der FDA, das Medikament zuzulassen, war sehr umstritten. Dennoch rechnet Biogen, der Hersteller von Aduhelm, damit, dass Aduhelm bis Ende Juni 2021 an mehr als 900 Gesundheitszentren in den Vereinigten Staaten ausgeliefert werden kann.
Aduhelm ist derzeit für geeignete Patienten außerhalb der Vereinigten Staaten auf der Basis eines "compassionate use" oder eines "named patient" verfügbar. Erfahren Sie mehr, indem Sie zum Abschnitt "Zugang zu Aduhelm außerhalb der Vereinigten Staaten" springen.
Die Alzheimer-Krankheit: eine der größten sozialen, medizinischen und wirtschaftlichen Krisen des 21.
Die Alzheimer-Krankheit ist eine degenerative Hirnerkrankung, von der heute weltweit über 40 Millionen Menschen betroffen sind und die die häufigste Ursache für Demenz ist. Viele Jahre lang wurde die Alzheimer-Krankheit als normaler Teil des Alterns angesehen, doch heute wird sie als eine Krankheit mit schwerwiegenden gesundheitlichen, wirtschaftlichen und sozialen Auswirkungen anerkannt.
Die Forscher wissen noch nicht genau, was die Alzheimer-Krankheit auslöst, aber es wird angenommen, dass sie durch eine Kombination von Faktoren verursacht wird, wie z. B.:
- Alterung: Alzheimer wird am häufigsten nach dem 65. Lebensjahr diagnostiziert (spät einsetzende Alzheimer-Krankheit). Etwa ein Drittel der Menschen im Alter von 85 Jahren und darüber ist an Alzheimer erkrankt. Altersbedingte Veränderungen des Gehirns können zur Entwicklung der Krankheit beitragen.
- Familiengeschichte: Wenn ein Familienmitglied ersten Grades an Alzheimer erkrankt ist, erhöht sich das Risiko einer Person, an der Krankheit zu erkranken. Wissenschaftler gehen davon aus, dass eine genetische Veranlagung zu einer früh einsetzenden Alzheimer-Krankheit führen kann, die bei Menschen im Alter von 30 bis Mitte 60 auftritt. Nur 10 % der Alzheimer-Patienten haben die früh einsetzende Form der Krankheit.
- Andere Faktoren: Wissenschaftler haben Zusammenhänge zwischen kognitivem Abbau und Herzkrankheiten sowie Diabetes und Fettleibigkeit festgestellt. Der stärkste Beweis ist die Verbindung zwischen der Gesundheit des Gehirns und der Gesundheit des Herzens. Kopfverletzungen wurden auch mit einem erhöhten Alzheimer-Risiko in Verbindung gebracht, da sie die Bildung von Amyloid-Plaques auslösen können. Menschen mit Down-Syndrom, bei denen ein zusätzliches Chromosom die genetische Kodierung für eine Art von Amyloid-Protein bestimmt, das mit Alzheimer in Verbindung gebracht wird, sind ebenfalls einem erhöhten Risiko ausgesetzt.
Die meisten Alzheimer-Patienten werden im milden Stadium diagnostiziert, wenn die Symptome stärker ausgeprägt sind und die Krankheit bereits einige Hirnschäden verursacht hat, obwohl einige Symptome bereits ein Jahrzehnt vor der Diagnose auftreten. Frühe Symptome können von den Patienten (oft aus Scham) vernachlässigt oder von Ärzten oder Familienangehörigen einfach nicht bemerkt werden. Die Patienten haben eine durchschnittliche Lebenserwartung von 3-11 Jahren nach der Diagnose.
"Mit der Zeit vergaß Mama, wer ich war"
Die Alzheimer-Krankheit hat drei verschiedene Stadien:
- Mild: In den ersten Stadien leiden die Patienten unter Gedächtnisverlusten wie dem Vergessen wichtiger Daten und Ereignisse, dem häufigen Wiederholen von Fragen, dem längeren Erledigen alltäglicher Aufgaben, ständigen Problemen mit den Finanzen, dem häufigen Verlegen von Gegenständen und Angstzuständen. (Weitere Informationen darüber, wie viel Gedächtnisverlust im Alter normal ist, finden Sie in dieser Infografik des National Institutes of Health (NIH), National Institute on Aging).
- Mäßig: Mit dem Fortschreiten der Krankheit kommt es zu zunehmendem Gedächtnisverlust und Verwirrung, zu Kommunikations- und Leseschwierigkeiten, zu Schwierigkeiten bei Routineaufgaben wie dem Anziehen, zu Problemen beim Erkennen von Familie und Freunden, zu Paranoia, Halluzinationen und Umherirren.
- Schwere Form: Patienten mit schwerer Alzheimer-Krankheit sind unfähig zu kommunizieren, haben Gewichtsverlust, Schluckbeschwerden und verlieren die Kontrolle über Darm und Blase. In diesem Stadium sind die Patienten die meiste Zeit bettlägerig und in ihrer Pflege vollständig auf andere angewiesen.
Die Nöte von Alzheimer-Patienten sind erschütternd, denn die Krankheit wirkt sich auf jeden Aspekt ihres täglichen Lebens aus. Im Folgenden können Sie einige Geschichten von Patienten oder von Freunden und Angehörigen von Patienten lesen.
Sandy, ein ehemaliger Zahnarzt und Assistenzprofessor in Harvard, sprach mit CNN-Reportern über seine Erkenntnis, dass seine Vergesslichkeit sich zu etwas Schlimmerem entwickelt hatte: "'Ich sehe mir anderthalb Stunden lang eine zahnärztliche Akte an', erinnert er sich. Ich lese sie, sie ist in meinem Gehirn. Dann schließe ich die Akte und kann mich buchstäblich an nichts mehr erinnern.'" Kurz darauf wurde bei ihm die Alzheimer-Krankheit diagnostiziert.
Fred Walker, bei dessen Frau die Alzheimer-Krankheit diagnostiziert wurde, sprach mit Alzheimer's Research UK über seine Frau: "Das Telefon zu benutzen, ging über ihre Fähigkeiten hinaus. Sie konnte nicht mehr alle Knöpfe bedienen. Der Herd war viel zu komplex, um ihn zu verstehen, und es bestand immer die Gefahr, dass sie das Gas anließ. Das Zubereiten einer Tasse Tee war ihr zu viel und sie wusste nicht mehr, wie viel Tee, Milch und Wasser sie brauchte."
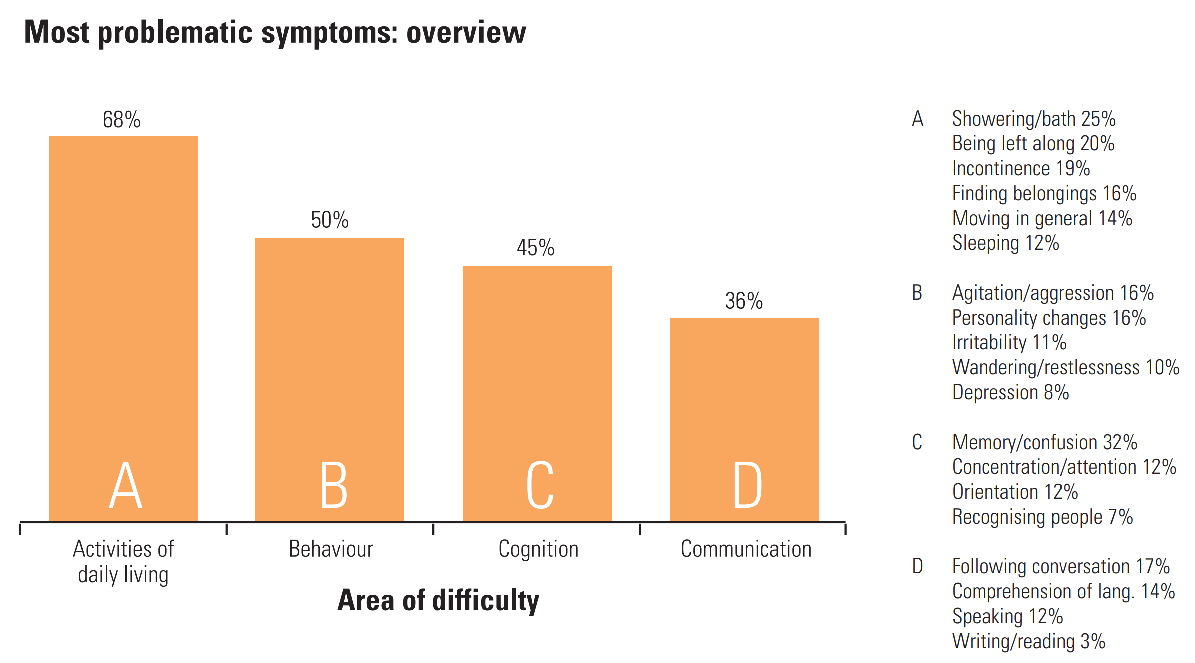
Die Alzheimer-Krankheit, wenn sie ein höheres Stadium erreicht und in eine Demenz übergeht, wird von Laury für die Alzheimer-Gesellschaft beschrieben:
"[...] wir begaben uns auf eine neue Reise. Eine, die eine 24-Stunden-Pflege, tägliche Medikamentenrunden und eine Mutter, die sich völlig im Nebel ihres eigenen Verstandes verlor, beinhaltete. [...] Erst zu diesem Zeitpunkt wurde uns klar, was für eine Horrorshow es bedeutete, einen geliebten Menschen mit dieser grausamen, heimtückischen Krankheit zu sehen. [...] Sie begann zu halluzinieren."
Der Gründer von everyone.org , Sjaak Vink, bestätigt und erkennt jede einzelne dieser Beschreibungen. Bei seiner Mutter wurde 2015 Alzheimer diagnostiziert.
Es ist ein schwieriger Weg für die Patienten und ihre Angehörigen - und die Krankheit beschränkt sich nicht darauf, nur ihr persönliches Leben und das Leben ihrer Angehörigen zu beeinträchtigen.
Druck auf Pflegekräfte, Budgets und politische Entscheidungsträger
Alzheimer-Patienten benötigen in dem Maße, in dem sich ihr Zustand verschlechtert, eine immer anspruchsvollere Pflege, z. B. häusliche Pflege, Nachtpflege, hauswirtschaftliche Versorgung oder Krankenpflege; schließlich kann es sein, dass die Patienten in betreuten Wohneinrichtungen oder Pflegeheimen leben müssen. Die Krankheit fordert einen hohen Tribut von den Patienten, ihren Familienmitgliedern (die sich oft der Pflege des Patienten widmen) sowie von ihren persönlichen und staatlichen Haushalten.
Pflegende Angehörige stehen vor einer schwierigen Aufgabe, wenn sie ihre an Alzheimer erkrankten Familienmitglieder betreuen. Eine Umfrage ergab, dass 95 % der pflegenden Angehörigen im Vereinigten Königreich angaben, dass dies ihre körperliche oder geistige Gesundheit beeinträchtigt. 69 % gaben an, sich ständig erschöpft zu fühlen, 64 % fühlten sich ängstlich und 49 % deprimiert.
In Europa sind rund 10 Millionen Menschen von der Alzheimer-Krankheit und anderen Formen der Demenz betroffen, und diese Zahl wird bis 2030 voraussichtlich auf 14 Millionen ansteigen. Die wirtschaftlichen Kosten der Demenz in Europa werden bis 2030 schätzungsweise auf über 250 Mrd. EUR ansteigen, wovon über 50 % auf die informellen Pflegekosten entfallen. Der Zugang zu Pflege und Behandlung ist ungleich, und insbesondere in Osteuropa fehlt es an Unterstützungssystemen und Sozialprogrammen für Alzheimer-Patienten und ihre Betreuer.
In den Vereinigten Staaten ist die Alzheimer-Krankheit vor kurzem in die Liste der 10 häufigsten Todesursachen aufgenommen worden und ist die einzige Krankheit unter den Top 10, für die keine Heilung bekannt ist. In den USA sind 6 Millionen Menschen von Alzheimer betroffen, und diese Zahl wird bis 2050 voraussichtlich auf 12 Millionen ansteigen. Bis Ende 2021 könnten sich die nationalen Gesamtkosten für die Pflege von Menschen mit Alzheimer und anderen Demenzerkrankungen auf 355 Milliarden Dollar belaufen und bis 2050 voraussichtlich 1,1 Billionen Dollar erreichen.
Diese Mittel, so astronomisch sie auch erscheinen mögen, sind notwendig, um den Patienten eine angemessene Unterstützung und ein möglichst würdiges Leben zu ermöglichen.
Aufgrund der Rund-um-die-Uhr-Pflege, die vor allem in den späteren Stadien erforderlich ist, sind Alzheimer-Patienten besonders betroffen, wenn ihre Pflege unzureichend ist, was in vielen Ländern oder Gemeinden der Fall ist. Allein im Vereinigten Königreich werden jedes Jahr Zehntausende von Demenzkranken wegen Infektionen, Stürzen und Dehydrierung, die auf unzureichende Pflege zurückzuführen sind, in die Notaufnahme eingeliefert. Dadurch werden die nationalen Gesundheitsbudgets weiter belastet.
Während der COVID-19-Pandemie waren Alzheimer-Patienten stark betroffen und mussten aufgrund ihres Alters, anderer langfristiger Gesundheitszustände und der Herausforderungen der Alzheimer-Krankheit selbst (z. B. Gedächtnisprobleme und Verwirrung, die es den Patienten erschweren, die Richtlinien zur Verhinderung von COVID-19-Infektionen zu befolgen) eine hohe Zahl von Todesfällen hinnehmen.
Alzheimer-Patienten in Pflegeheimen haben die schädlichen Folgen auch auf andere Weise zu spüren bekommen. Aufgrund der unzureichenden Pflege und der erzwungenen Trennung von ihren Angehörigen, um sie vor COVID-19 zu schützen, hat die daraus resultierende Einsamkeit und Isolation ihre geistige und körperliche Gesundheit weiter verschlechtert.
Wirksame Behandlungen für die Krankheit sind erforderlich, um zu verhindern, dass die Gesundheits- und Wirtschaftskrise schwere Ausmaße annimmt.
Höhepunkte in der Alzheimer-Forschung
Im Jahr 1910 benannte der deutsche Arzt Emil Kraepelin die Krankheit "Alzheimer-Krankheit" nach dem Arzt Alois Alzheimer, der bei einem Patienten mit starkem Gedächtnisverlust und zunehmenden psychischen Veränderungen pathologische Merkmale einer präsenilen Demenz entdeckte. Die Forschung zur Behandlung der Alzheimer-Krankheit begann erst in den späten 1980er Jahren in den Vereinigten Staaten, stieß aber auf Kritik, da die Ärzte immer noch glaubten, dass Alzheimer eine unvermeidliche Folge des Alterns sei.
In den Vereinigten Staaten starteten 1978 das National Institute on Aging (NIA) und die Alzheimer's Association in Zusammenarbeit mit Pfizer die erste klinische Studie für ein Medikament zur Behandlung der Symptome der Alzheimer-Krankheit. Das Medikament wurde 1993 zugelassen: Cognex (Tacrine) verbesserte den veröffentlichten Ergebnissen zufolge bei einigen Patienten die kognitiven Fähigkeiten, konnte aber die Verschlimmerung der Krankheit nicht aufhalten.
Im Laufe des nächsten Jahrzehnts wurden sechs weitere Medikamente zugelassen, alle zur Behandlung der kognitiven Symptome der Alzheimer-Krankheit:
- Aricept (Donepezil): zur Behandlung von Symptomen im Zusammenhang mit Gedächtnis und Denken
- Razadyne (Galantamin): zur Behandlung von Symptomen im Zusammenhang mit Gedächtnis und Denken
- Exelon (Rivastigmin): zur Behandlung von Symptomen im Zusammenhang mit Gedächtnis und Denken
- Namenda (Memantine): zur Verbesserung von Gedächtnis, Aufmerksamkeit, Verstand und Sprache
- Namzaric (Memantin + Donepezil): eine Kombination der oben genannten Wirkstoffe
- Belsomra (Suvorexant): zur Behandlung von Schlaflosigkeit bei Alzheimer-Patienten
Das letzte Medikament, das für die Behandlung der Alzheimer-Krankheit zugelassen wurde, wurde 2003 genehmigt. Jahrzehntelang wurde die Alzheimer-Krankheit als eine natürliche Folge des Alterns betrachtet. Es wurden nur wenige Ressourcen für die Suche nach einer Behandlung aufgewendet, da umstritten war, ob es sich tatsächlich um eine Krankheit handelt. In den letzten 20 Jahren haben die Forscher jedoch umfangreiche Mittel für die Erforschung der Krankheit und die Entwicklung einer Behandlung bereitgestellt.
Das Fehlen von Alzheimer-Therapien ist nicht auf Nachlässigkeit seitens der Pharmaunternehmen zurückzuführen - die Branche hat insgesamt Milliarden in die Forschung investiert. Allein das Unternehmen Eli Lilly hat über drei Jahrzehnte hinweg 4,2 Milliarden Dollar für die Entwicklung eines erfolgreichen Medikaments ausgegeben, und die National Institutes of Health (NIH) der Vereinigten Staaten haben mehr als 500 Millionen Dollar pro Jahr für die Erforschung und Entwicklung von Behandlungen ausgegeben.
Seit 2013 hat der US-Kongress das Jahresbudget der NIH für die Finanzierung der Alzheimer-Forschung und damit zusammenhängender Demenzerkrankungen verdreifacht, so dass es 2019 bei 3,1 Milliarden Dollar liegen wird.
Mit staatlichen und privaten Mitteln wurden bis 2019 2173 klinische Studien durchgeführt, um verschiedene Theorien zu testen. Die wichtigsten Theorien wurden getestet:
- 19% der Studien konzentrierten sich auf eine Neurotransmitter-Hypothese
- 17,0 % der Studien prüften eine mitochondriale Kaskadenhypothese und andere verwandte Hypothesen
- 12,7 % testeten die Hypothese der Tau-Ausbreitung
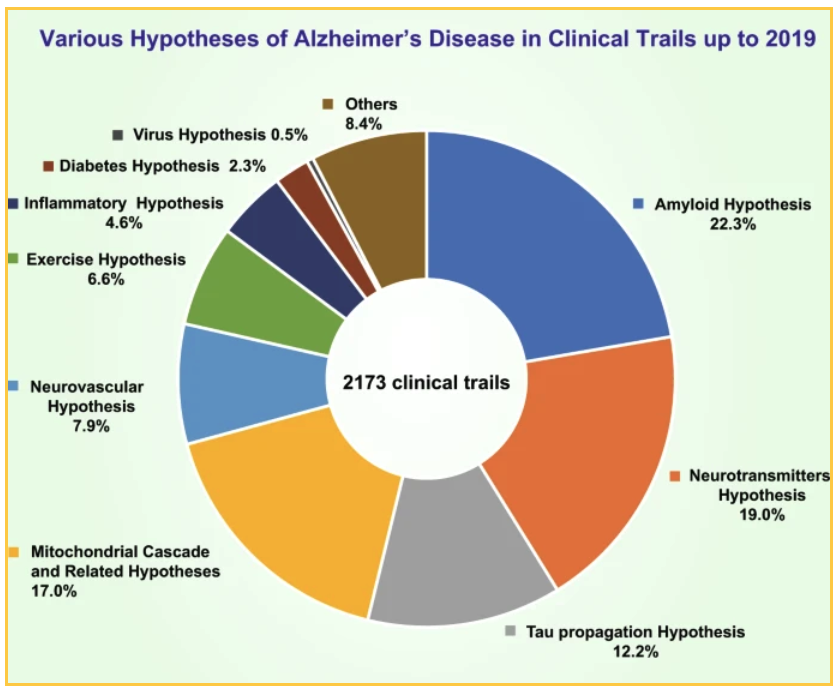
Die 22,3 % der Studien, die auf Amyloid abzielen, konzentrieren sich auf verschiedene Methoden zur Verringerung der Plaque:
- Vom Immunsystem erzeugte Antikörper gegen Beta-Amyloid: "Aktive Impfstoffe", die, wenn sie in den Körper injiziert werden, das Immunsystem zur Produktion von Antikörpern anregen, die Beta-Amyloid zerstören und die Beta-Amyloid-Konzentration im Gehirn verringern.
- Im Labor hergestellte Antikörper gegen Beta-Amyloid: "Passive Impfstoffe", die als wirksamer und sicherer gelten als der Versuch, die körpereigene Antikörperproduktion anzuregen.
- Verringerung der Beta-Amyloid-Produktion: Einige experimentelle Behandlungen verändern das Verhalten bestimmter Proteine, die die Beta-Amyloid-Produktion verhindern oder verringern können.
- Verhinderung der Beta-Amyloid-Aggregation: Wissenschaftler erforschen Medikamente, die die anfänglichen Wechselwirkungen zwischen Beta-Amyloid und Gehirnzellen verhindern, die zum Absterben der Gehirnzellen führen.
- Verstärkung des Beta-Amyloid-Abbaus: Techniken wie die Mobilisierung des Immunsystems zum Angriff auf das Beta-Amyloid oder die Verabreichung natürlicher Wirkstoffe mit Anti-Amyloid-Wirkung.
- Natürliche Wirkstoffe mit Anti-Amyloid-Wirkung: Intravenöses Immunglobulin (IVIg), das von menschlichen Blutspendern gewonnen wird, enthält natürliche Antikörper, die den Beta-Amyloid-Spiegel senken können.
Was ist Aduhelm aducanumab-avwa)?
Aduhelm (Aducanumab) ist ein Anti-Amyloid-Antikörper für die Behandlung der Alzheimer-Krankheit. Er soll Beta-Amyloid-Plaques entfernen, die sich bei Patienten mit Alzheimer-Krankheit in abnormalen Mengen zwischen den Gehirnzellen bilden und zum Absterben der betroffenen Gehirnzellen führen. Das Beta-Amyloid wurde 1984 identifiziert und galt schnell als Hauptauslöser für die Schädigung der Gehirnzellen, während 1986 das Tau-Protein identifiziert wurde, ein Hauptbestandteil der Verknotungen und ein zweiter Auslöser für den Verfall der Gehirnzellen.
Aduhelm wurde von Biogen, Inc. entwickelt, einem multinationalen Biotechnologieunternehmen mit Sitz in Massachusetts, Vereinigte Staaten. Aduhelm wird als monatliche Injektion verabreicht.
Aduhelm hat eine lange Geschichte.
Das Schweizer Biotech-Unternehmen Neurimmune Therapeutics AG hat in Zusammenarbeit mit der Universität Zürich die schützenden Anti-Amyloid-Antikörper bei gesunden älteren Menschen und bei Patienten mit langsam fortschreitender Demenz identifiziert, was zur Entdeckung von Aducanumab, dem Wirkstoff von Aduhelm, geführt hat. Bei Patienten mit leichter Alzheimer-Krankheit führen monatliche intravenöse Infusionen von Aducanumab über ein Jahr zu einer Verringerung der Amyloid-Plaque, was zu einer Verlangsamung des kognitiven Abbaus führt.
Neurimmune hat Biogen 2007 eine Lizenz für Aducanumab zur Behandlung der Alzheimer-Krankheit erteilt und arbeitet bei der Entwicklung des Medikaments mit Biogen zusammen.
Wie funktioniert Aduhelm ?
Die Alzheimer-Krankheit scheint das Ergebnis einer ungewöhnlichen Anhäufung von zwei Proteinen im Gehirn zu sein, nämlich Beta-Amyloid und Tau. Beta-Amyloid ist ein Protein, das normalerweise im Gehirn vorhanden ist und bei der Alzheimer-Krankheit zu Amyloid-Plaques zwischen den Gehirnzellen verklumpt - die Amyloid-Theorie besagt, dass diese Plaques die Gehirnzellen schädigen und schließlich abtöten. Amyloid-Plaques scheinen sich in einem früheren Stadium der Krankheit zu entwickeln, während Tau-Verwirrungen eher in einem späteren Stadium der Krankheit auftreten. Ein Großteil der Forschungsarbeiten zur Behandlung der Alzheimer-Krankheit konzentrierte sich auf die Beseitigung der Amyloid-Plaques.
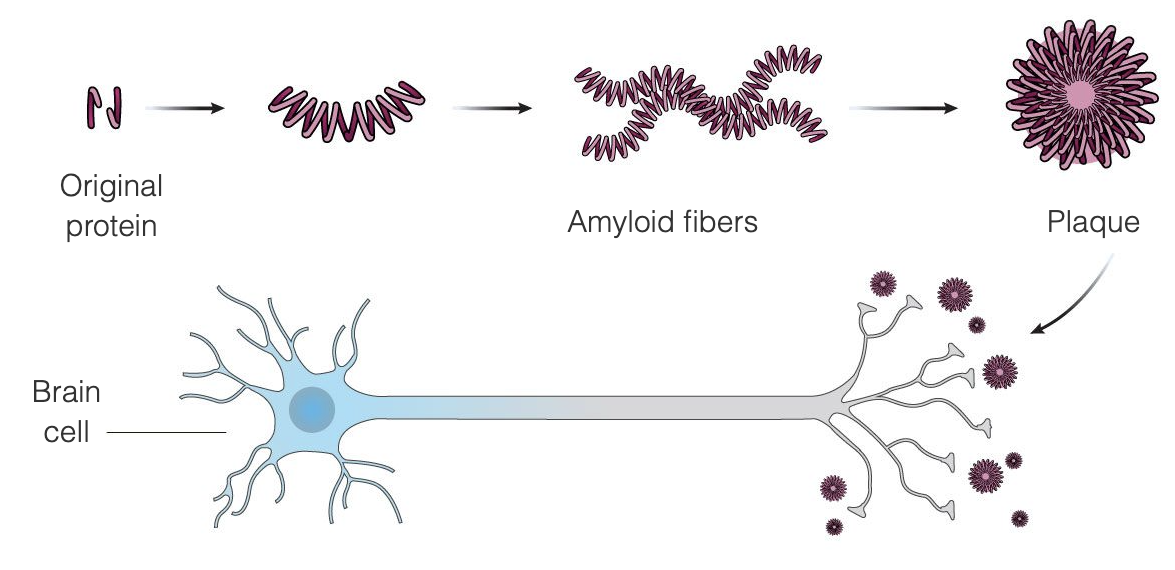
Aduhelm soll die Alzheimer-Krankheit in einem sehr frühen Stadium behandeln, indem es an die Amyloid-Plaques bindet und so das Immunsystem veranlasst, die Plaques zu zerstören, da es sie als fremde Eindringlinge betrachtet. Sobald die Plaques entfernt sind, sollen die Gehirnzellen nicht mehr absterben und die kognitiven Funktionen sich nicht mehr verschlechtern. Aduhelm nutzt diesen Mechanismus mit dem Ziel, das Fortschreiten der Krankheit zu verlangsamen, und richtet sich insbesondere an Patienten in den frühen Stadien der Alzheimer-Krankheit. Aduhelm macht bereits eingetretene Schäden nicht rückgängig.
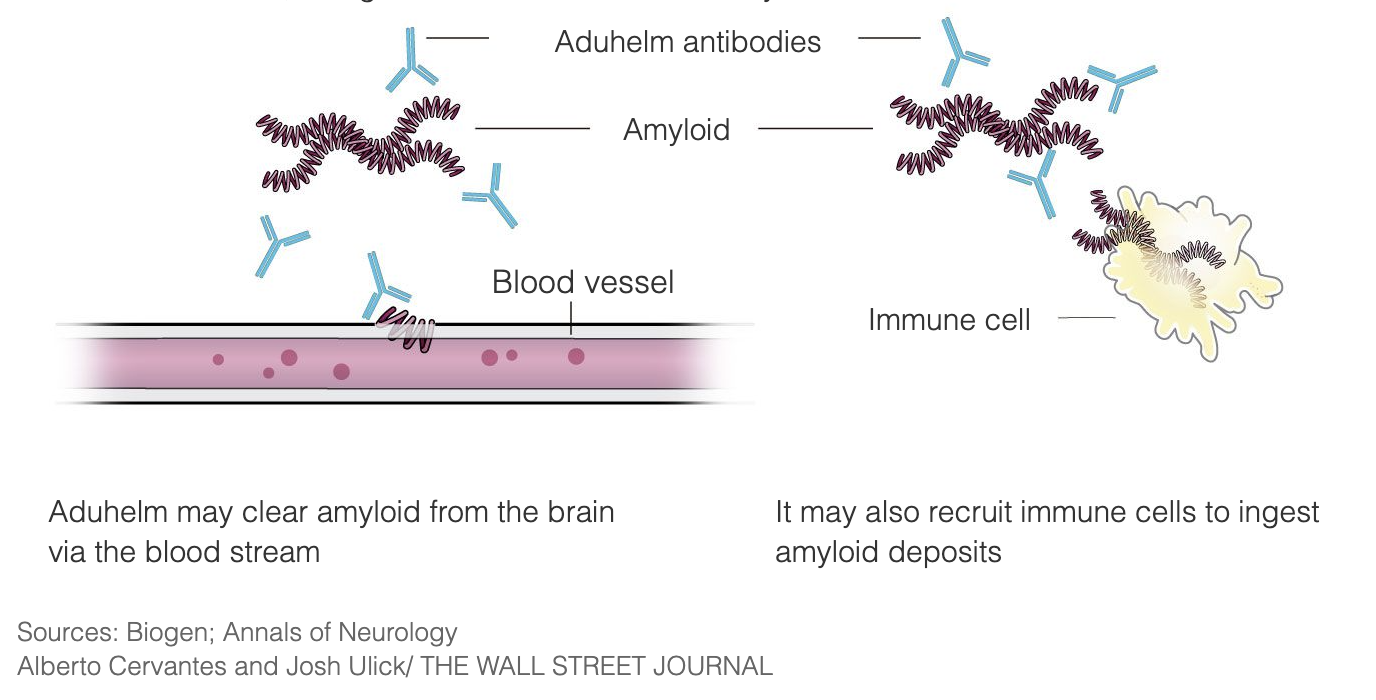
Amyloid-Plaques sind seit drei Jahrzehnten ein Ziel der Alzheimer-Forschung und der Entwicklung von Medikamenten, und Aduhelm ist eine dieser Behandlungen, die im Laufe der Jahre erforscht wurden.
"Die Kirche der Heiligen Amyloid"
Die Wissenschaftler sind sich noch nicht einig darüber, was die Alzeimer-Krankheit verursacht, aber sie haben einige Theorien. Eine davon wird als "Amyloid-Hypothese" bezeichnet, und Aduhelm wurde unter der Annahme entwickelt, dass diese Theorie richtig ist.
Die Amyloid-Hypothese besagt, dass Amyloid-Plaques, die sich zwischen den Gehirnzellen bilden, zum Absterben der Zellen und damit zum kognitiven Verfall führen. Es handelt sich um eine seit langem bestehende Theorie, die nie allgemein akzeptiert wurde - und der bisherige Misserfolg der klinischen Studien, die auf Amyloid-Plaques abzielen, hat ihre Kritiker ermutigt. Manche bezeichnen die Gruppe der Befürworter dieser Theorie als "Kirche des heiligen Amyloids", weil sie sich gegen alternative Theorien sträuben, ja sie sogar ablehnen.
Selbst die normale Funktion von Beta-Amyloid im Gehirn ist unter Forschern umstritten, da sie sich nicht einig sind, welche Rolle es natürlicherweise im menschlichen Körper spielt oder ob es ausschließlich ein Marker für die Alzeimer-Krankheit ist.
Ein gängiges Gegenargument zur Amyloid-Hypothese ist die Tatsache, dass Plaques in den Gehirnen vieler älterer Menschen mit normaler Kognition gefunden werden. Interessanterweise wurden bei einigen Postmortem-Untersuchungen von über 90-jährigen Menschen mit außergewöhnlichen Erinnerungen Amyloid-Plaques in unterschiedlichem Ausmaß in ihren Gehirnen gefunden - einige von ihnen hatten eine so hohe Dichte, dass sie den schwersten Fällen von Alzheimer ähnelten, und sie hatten auch viel mehr Neuronen als Menschen, die an Alzheimer gestorben waren.
Einige Forscher glauben, dass Beta-Amyloid sogar eine schützende Funktion haben könnte.
George Perry, Neurobiologe an der University of Texas in San Antonio, vermutet, dass die Anhäufung von Beta-Amyloid und Tau eine schützende Reaktion auf den altersbedingten Stoffwechseldruck in der Zelle ist" und besonders hilfreich bei der Verringerung des oxidativen Stresses im Gehirn ist (der oxidative Stress nimmt mit dem Alter zu, was die Zellen schädigt).
Mehrere Studien haben andere mögliche Ursachen der Alzheimer-Krankheit untersucht. Eine dieser Studien wurde von Forschern der Icahn School of Medicine am Mount Sinai in New York geleitet, die entdeckten, dass zwei Stämme eines Virus namens HHV (Teil der Herpesvirus-Familie) in größeren Mengen in den Gehirnen von Menschen mit Alzheimer-Krankheit zu finden sind. Es ist zwar nicht sicher, dass diese beiden Viren die Krankheit verursachen (wahrscheinlicher ist eine Kombination aus Virus und einer bestimmten Genvariante namens APOE), aber die Daten deuten darauf hin, dass eine Infektion das Risiko, an Alzheimer zu erkranken, erhöht und dass bei Menschen, die mit antiviralen Medikamenten behandelt werden, die Wahrscheinlichkeit, an Alzheimer zu erkranken, zehnmal geringer ist.
Für die Amyloid-Theorie sprechen jedoch genetische Befunde, die einen Zusammenhang zwischen amyloidbedingten Genproblemen und der Entwicklung der Alzheimer-Krankheit im Frühstadium (bei Menschen zwischen 30 und 65 Jahren) herstellen. Das Down-Syndrom gilt als Risikofaktor, da Forscher herausgefunden haben, dass Menschen mit Down-Syndrom eine zusätzliche Kopie eines Chromosoms haben, das das Gen enthält, das für ein Amyloid-Protein kodiert, das mit der früh einsetzenden Alzheimer-Krankheit in Verbindung steht.
Andere genetische Anomalien können zur Produktion längerer Beta-Amyloid-Varianten führen, die leichter Plaques bilden, oder die Beta-Amyloid-Produktion erhöhen und etwas seltenere Fälle von früh einsetzender Alzheimer-Krankheit verursachen. Mehrere Familienmitglieder einer Familie können Träger dieser Genmutationen sein und das Risiko einer Person erhöhen, an Alzheimer im Frühstadium zu erkranken.
Befürworter der Amyloid-Theorie weisen darauf hin, dass frühere Studien mit Arzneimitteln, die auf Amyloid-Plaques abzielten , einfach fehlerhaft waren. So verschlechterte sich beispielsweise in einer Studie mit Semagacestat, einem Hemmstoff für die Produktion von Beta-Amyloid-Proteinen, die kognitive Leistungsfähigkeit der Studienteilnehmer; außerdem beobachteten die Forscher bei den Teilnehmern eine Zunahme von Hautkrebs. Dies könnte darauf zurückzuführen sein, dass Semagacestat nicht nur die Produktion von Beta-Amyloid, sondern auch von anderen Proteinen hemmte, von denen einige wichtige Funktionen im menschlichen Körper haben.
Die am meisten unterstützte Erklärung für das Scheitern dieser Studien, die auf Amyloide abzielen, ist, dass die Medikamente die richtigen sind, aber zum falschen Zeitpunkt im Verlauf der Alzheimer-Krankheit verabreicht werden - sie werden zu spät im Prozess der Bildung von Amyloid-Plaques verabreicht, einem Prozess, der Jahrzehnte vor dem Auftreten von Symptomen beginnt.
Michael Murphy, Neurowissenschaftler an der Universität von Kentucky, stellt fest, dass "wir wahrscheinlich bereits ein Medikament haben, mit dem die Alzheimer-Krankheit behandelt werden könnte, wenn wir es Menschen in ihren 50ern geben würden".
Über die Ursachen der Alzheimer-Krankheit wird viel diskutiert, und die Experten sind sich noch nicht einig - aber Patienten und Forscher haben durch die Ergebnisse von Aducanumab in einer der klinischen Phase-3-Studien von Aduhelmneuen Wind bekommen.
Aduhelm in klinischen Studien
Klinische Prüfungen finden in vier Phasen statt:
- Phase 0: Das Medikament wird in sehr geringen Mengen an weniger als 15 Teilnehmern getestet, um sicherzustellen, dass es nicht schädlich ist und die Studie fortgesetzt werden kann.
- Phase 1: Das Medikament wird an 20 bis 80 Teilnehmern ohne gesundheitliche Vorbelastung getestet, um sicherzustellen, dass es keine schwerwiegenden Nebenwirkungen hat. Nach Angaben der FDA gelangen etwa 70 % der Arzneimittel in die Phase 2.
- Phase 2: Das Arzneimittel wird über einen Zeitraum von einigen Monaten oder Jahren an mehreren hundert Teilnehmern mit der Erkrankung, für die es bestimmt ist, getestet, um Informationen über seine Wirksamkeit und Nebenwirkungen zu sammeln. Etwa 33 % der Arzneimittel gelangen in die Phase 3.
- Phase 3: Das Medikament wird an bis zu 3000 Teilnehmern mit der Erkrankung, für die es bestimmt ist, getestet und kann mehrere Jahre dauern. Das Medikament muss sich als sicher und wirksam erweisen. 25-30 % der Arzneimittel gelangen in die Phase 4.
- Phase 4: Diese Phase umfasst Tausende von Teilnehmern über viele Jahre hinweg und findet statt, nachdem die FDA das Medikament zugelassen hat. Sie dient dazu, mehr Informationen über die langfristige Sicherheit und Wirksamkeit des Medikaments zu sammeln.
Aduhelm in Phase 1
Biogen führte mehrere klinische Studien zur Untersuchung von Aducanumab durch, beginnend mit drei Phase-1-Studien im Jahr 2011, in denen Aducanumab an gesunden Freiwilligen und an Alzheimer-Patienten in den USA und Japan getestet wurde, wobei mit unterschiedlichen Dosierungen von Aducanumab und Placebo gearbeitet wurde. Einige Patienten wurden über 3 Jahre lang beobachtet.
Im Jahr 2016 veröffentlichte Biogen die Ergebnisse seiner klinischen Phase-1-Studie, in der Forscher ein Jahr lang monatliche intravenöse Infusionen mit Aducanumab an Studienteilnehmer mit leichter Alzheimer-Krankheit verabreichten. Bei den mit Aducanumab behandelten Studienteilnehmern sanken die Beta-Amyloid-Konzentrationen im Gehirn und der kognitive Abbau verlangsamte sich, gemessen an einem offiziellen klinischen Demenz-Rating. Bei den Teilnehmern, die Aducanumab-Infusionen erhielten, verzeichneten die Forscher von Biogen auch einen Rückgang von Nebenwirkungen wie ARIA (amyloidbedingte Bildgebungsanomalien, z. B. Hirnödeme oder Blutungen im Gehirn). Biogen erachtete diese Ergebnisse als ausreichend ermutigend, um mit Phase 2 fortzufahren.
Aduhelm in Phase 2
Biogen begann Ende 2018 mit Phase-2-Studien und untersuchte die Sicherheit der fortgesetzten Verabreichung von Aducanumab sowie die Verringerung der Amyloid-Plaques und die Verlangsamung des kognitiven Abbaus bei Teilnehmern mit Alzheimer-Krankheit im Frühstadium und mit Symptomen.
Aducanumab verfehlte sein primäres Ziel, den kognitiven Verfall nach 12 Monaten zu verlangsamen, aber nachdem 18 Monate der Studiendaten in einer Reanalyse überprüft worden waren, wurden bei einer von fünf Dosierungen - der höchsten Dosis von Aducanumab - positive Auswirkungen beobachtet. Es zeigte sich, dass die höchste Dosis die Amyloid-Plaques im Gehirn verringerte und sich auch positiv auf die kognitiven Fähigkeiten auswirkte.
Wie in Phase 1 wurden Nebenwirkungen wie ARIA (amyloidbedingte Bildgebungsanomalien) bei etwa 10 % aller Teilnehmer und bei weniger als 15 % der Teilnehmer, die die höchsten Dosen von Aducanumab erhielten, beobachtet.
Die 18-Monats-Ergebnisse der BAN2401-Studie sind beeindruckend und liefern eine wichtige Unterstützung für die Amyloid-Hypothese", sagte Jeff Cummings, Gründungsdirektor des Cleveland Clinic Lou Ruvo Center for Brain Health, in einer Stellungnahme für Biospace.
Aduhelm in Phase 3
Nach den Ergebnissen der Phase-2-Studie führte Biogen zwei Phase-3-Studien mit den Bezeichnungen Engage und Emerge durch, in die knapp 3300 Teilnehmer mit relativ leichter Alzheimer-Krankheit in Nordamerika, Australien, Europa und Asien aufgenommen wurden. Aducanumab wurde einmal im Monat in niedriger und hoher Dosierung per Injektion in die Blutbahn verabreicht und mit den Ergebnissen von Teilnehmern verglichen, die ein Placebo erhielten.
Im März 2019 brach Biogen die beiden Phase-3-Studien ab und berief sich dabei auf eine von einem unabhängigen Datenüberwachungsausschuss durchgeführte Futility-Analyse, die zu dem Schluss kam, dass Aducanumab nicht wie vorgesehen zu wirken scheint.
Die Entscheidung betraf 3300 Studienteilnehmer. Die Protokolle für die Teilnahme an der Studie sahen häufige und ausgedehnte Besuche vor und umfassten Blutabnahmen, MRTs, PET-Scans und manchmal auch Ableitungen der Wirbelsäule. Sieben Monate nach dem Abbruch der beiden Studien gab Biogen bekannt, dass eine erneute Analyse zusätzlicher Daten darauf hindeutet, dass das Medikament in hohen Dosen den kognitiven Verfall zu verringern scheint.
Wie Biogen in einer Pressemitteilung schreibt, bestehen die zusätzlichen Daten aus den Ergebnissen einer Untergruppe von Patienten in der Phase-3-Studie Engage, die eine hohe Dosis Aducanumab erhielten und bei denen eine signifikante Verringerung der kognitiven und funktionellen Beeinträchtigungen (Gedächtnis, Orientierung, Sprache) sowie Vorteile bei Aktivitäten des täglichen Lebens (Erledigung von Hausarbeiten, Einkaufen, selbstständiges Verlassen des Hauses) festgestellt wurden. Auf der Grundlage dieser Ergebnisse beantragte Biogen im Oktober 2019 die Zulassung für Aducanumab und erhielt sie Anfang Juni 2021.
Obwohl die klinischen Studien der Phase 3 nicht vollständig schlüssig waren, was den Nutzen der Therapie in Bezug auf Kognition und Funktion betrifft, kam die FDA zu dem Schluss, dass die Studien gezeigt haben, dass Aducanumab, das unter dem Handelsnamen Aduhelm hergestellt wird, Amyloid-Plaques reduzieren kann, was die Grundlage für die beschleunigte Zulassungsentscheidung der FDA bildete.
Studienteilnehmer und Reporter Phil Gutis schrieb für die Nachrichtenplattform Being Patient: "Ich habe durch einen PET-Scan der Längsschnittstudie erfahren, dass ich kein Amyloid mehr in meinem Gehirn habe. Der Scan, der vor etwa zwei Jahren im Rahmen der Aging Brain Cohort Studie am Penn Memory Center durchgeführt wurde, bestätigte meine zunehmende Ahnung, dass Aducanumab mir tatsächlich hilft. Ich hatte das Gefühl, aus einem ständigen geistigen Nebel herauszukommen ... Die negative Seite ist, dass die Erinnerungen, die ich verloren habe, nicht zurückgekehrt sind.
Nebenwirkungen und Kontraindikationen von Aduhelm
Laut dem Arzneimittelführer von Biogen sollten Patienten, bevor sie Aduhelm in Erwägung ziehen, ihre medizinischen Betreuer über alle ihre medizinischen Bedingungen informieren, einschließlich der Frage, ob sie:
- schwanger sind oder planen, schwanger zu werden
- stillen oder planen zu stillen
Die Patienten sollten ihren medizinischen Betreuer über alle Medikamente informieren, die sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Medikamente, Vitamine und pflanzlicher Ergänzungsmittel.
Laut dem Arzneimittelführer von Biogen ist die wichtigste bekannte Nebenwirkung von Aduhelm ARIA (Amyloid-bedingte Bildgebungsanomalien), wie z. B. Hirnödeme und Blutungen im Gehirn. Die anderen Nebenwirkungen sind:
- schwere allergische Reaktionen wie Anschwellen des Gesichts, der Lippen, des Mundes oder der Zunge und Nesselsucht
- Kopfschmerzen
- Diarrhöe
- Verwirrung/Delirium/veränderter Geisteszustand/Desorientierung
- fällt
ARIA ist eine häufige Nebenwirkung, die in der Regel keine Symptome verursacht, aber schwerwiegend sein kann. Meistens handelt es sich um eine vorübergehende Schwellung des Gehirns, die sich in der Regel mit der Zeit von selbst zurückbildet. Gleichzeitig wird durch die Entfernung von Amyloid aus dem Gehirn auch Amyloid aus den Blutgefäßen entfernt, was zu kleinen Blutungen in oder auf der Oberfläche des Gehirns führen kann.
ARIA wurde bei 41 % der Teilnehmer an den klinischen Studien beobachtet, die Aducanumab erhielten, verglichen mit 10 % der Teilnehmer, die ein Placebo erhielten.
Obwohl die meisten Menschen mit Schwellungen in Hirnregionen keine Symptome haben, können etwa 30 % der Menschen leichte Symptome haben, wie zum Beispiel:
- Verwirrung
- Kopfschmerzen
- Schwindelgefühl
- Änderungen der Vision
- Übelkeit
Daniel Gibbs, Neurologe im Ruhestand und langjähriger Teilnehmer an den klinischen Studien Aduhelm , berichtete von seinen Erfahrungen mit einer extrem seltenen ARIA-Nebenwirkung:
"Ich sollte zunächst sagen, und das ist das Dogma, das weitgehend stimmt, dass [ARIAs] in der Regel gutartig sind. Die meisten Menschen wissen nicht, dass sie es haben. [ARIAs] werden nur auf MRT-Scans entdeckt, auf denen kleine Schwellungen oder winzige Eisenablagerungen durch Blutungen zu sehen sind. Wenn die Betroffenen Symptome haben, sind sie in der Regel leicht. Am häufigsten treten Kopfschmerzen auf, gelegentlich auch Verwirrung.
Aber fast immer, auch bei symptomatischer ARIA, verschwinden die Symptome innerhalb weniger Monate, wenn Sie das Medikament absetzen. Das Medikament kann gefahrlos wieder eingenommen werden. Es gab nur sehr wenige Fälle, zumindest die, die vom Hersteller des Medikaments Biogen erörtert wurden, [von] katastrophalen oder schweren ARIA, und meiner gehörte zu dieser Kategorie. [...]
Meine Kopfschmerzen begannen zuzunehmen. Ich habe nicht selten Kopfschmerzen, also habe ich mir nichts dabei gedacht, aber sie wurden etwas häufiger und vielleicht auch etwas heftiger, aber sie ließen sich immer noch mit rezeptfreien [Medikamenten] lindern. [...]
Dann, ein oder zwei Nächte vor Weihnachten 2017, hatte ich die schlimmsten Kopfschmerzen meines Lebens, die Art, die wir als Neurologen mit einer Subarachnoidalblutung, einer massiven Blutung ins Gehirn, in Verbindung bringen würden. Ich habe meinen Blutdruck gemessen und er war extrem hoch und blieb hoch, so dass ich dachte, ich hätte einen Schlaganfall.
Ich ließ mich von meiner Frau in die Notaufnahme bringen, und als ich in unserem örtlichen Krankenhaus ankam, konnte ich wirklich keine zusammenhängende Geschichte erzählen. [...]
Aber nach ein paar Tagen ging es mir schon ein wenig besser. Meine Kopfschmerzen verschwanden, aber ich hatte immer noch Probleme beim Lesen. Im Laufe des nächsten Monats wurde es dann etwas schlimmer. Meine MRT-Scans zeigten, dass es sich um ARIA handelte, und zwar sowohl wegen der Schwellung als auch wegen der Blutung in meinem gesamten Gehirn. Da sie sich verschlimmerte, war man der Meinung, dass sie behandelt werden sollte. Ich erhielt fünf hochdosierte Steroide, die sofort die Kopfschmerzen und die Verwirrung linderten. Aber es dauerte etwa sechs Monate, bis die Schwellungen in meinem Gehirn völlig verschwunden waren."
Angesichts dieser seltenen, aber schwerwiegenden potenziellen Nebenwirkungen müssen die medizinischen Betreuer der Patienten vor und während der Behandlung mit Aduhelm Magnetresonanztomographie-Scans (MRT) durchführen, um auf ARIA zu prüfen.
Zulassung von Aduhelm (Aducanumab)
Am 7. Juni 2021 erteilte die FDA eine beschleunigte Zulassung für Aduhelm (Aducanumab) zur Behandlung der Alzheimer-Krankheit.
Bei der beschleunigten Zulassung handelt es sich um eine Art der Zulassung, die für Arzneimittel erteilt werden kann, die in klinischen Versuchen eine positive therapeutische Wirkung zeigen, bevor alle schlüssigen Beweise vorgelegt wurden. Dies kann nur für Arzneimittel für schwerwiegende Erkrankungen gelten, für die ein ungedeckter medizinischer Bedarf besteht; das letzte zugelassene Arzneimittel zur Behandlung der Alzheimer-Krankheit wurde vor mehr als 18 Jahren zugelassen.
Die beschleunigte Zulassung wird unter Auflagen erteilt. Die FDA fordert den Hersteller Biogen auf, eine neue klinische Studie durchzuführen, um den klinischen Nutzen des Medikaments zu überprüfen. Wenn die Studie keinen Nutzen zeigt, könnte die FDA die Zulassung des Medikaments zurückziehen. Biogen hat bis 2029 Zeit, eine weitere klinische Studie durchzuführen, um den Nutzen von Aducanumab für Alzheimer-Patienten zu bestätigen. Experten argumentieren, dass eine dritte klinische Studie, die in zwei Jahren abgeschlossen werden könnte, eine bessere Option gewesen wäre, als acht Jahre zu warten, um herauszufinden, ob das Medikament wirkt, während die Patienten sich der teuren Behandlung unterziehen und auf das Beste hoffen.
Eine medizinische Kontroverse mit finanziellen Untertönen
Die Entscheidung der FDA, Aducanumab zuzulassen, hat Experten verblüfft, die sagen, dass es nicht genügend Beweise dafür gibt, dass Aduhelm eine wirksame Behandlung für die Alzheimer-Krankheit ist. Viele von ihnen, darunter auch ein unabhängiges Gremium, wiesen die FDA darauf hin, dass die vorliegenden Beweise erhebliche Zweifel daran aufkommen lassen, dass Aducanumab den kognitiven Verfall verlangsamen kann, und debattierten darüber, ob positive Ergebnisse aus nur einer der beiden Phase-3-Studien eine ausreichende Grundlage für die FDA-Zulassung sind.
Kurz nach der Zulassung traten drei Wissenschaftler aus Protest aus dem unabhängigen Ausschuss aus, der die FDA in Bezug auf die Behandlung beriet, und begründeten dies mit dem Mangel an überzeugenden Beweisen. Sie kritisierten auch die Entscheidung der FDA, Aducanumab für alle Alzheimer-Patienten zuzulassen, obwohl die Studie an Alzheimer im Frühstadium durchgeführt wurde und die Theorie akzeptiert wurde, dass die Verringerung der Amyloid-Plaque die kognitiven Symptome tatsächlich verlangsamen würde (obwohl die wissenschaftliche Gemeinschaft die Gültigkeit dieser Theorie nicht anerkennt).
Die Entscheidung der FDA, Aducanumab unter diesen Bedingungen zuzulassen, könnte mehrere Auswirkungen haben.
- Andere Medikamente, die auf Amyloid-Plaques abzielen, wie z. B. Donanemab von Eli Lilly, könnten schneller als bisher prognostiziert zugelassen werden, was das Interesse von Pharmaunternehmen weckt, in Alzheimer-Medikamente zu investieren oder ihre Beteiligung an bestehenden Studien fortzusetzen.
- Die Entscheidung der FDA hat den Eindruck einer regulatorischen Flexibilität erweckt, die andere Biotech-Unternehmen zur Entwicklung von Arzneimitteln für seltene Krankheiten anregen könnte - ein Antrieb, der nach einer langen Reihe von Fehlschlägen bei klinischen Studien, insbesondere in den 18 Jahren zwischen den Zulassungen von Alzheimer-Therapien, nachgelassen hat.
- Das Medikament ist mit 56 000 Dollar pro Jahr recht kostspielig, was bedeutet, dass die Tarife der privaten Krankenversicherungen steigen könnten, da die Versicherer dafür aufkommen müssen, und dass die Steuerzahler im Rahmen von Medicare (der nationalen Krankenversicherung der USA) stärker belastet werden. Einige sagen, dass es für Medicare "verheerend" sein könnte, nicht nur wegen der Grundkosten, sondern auch, weil die Behandlung mit Aduhelm eine frühere Diagnose durch Anzapfen der Wirbelsäule zur Erkennung von Amyloid und eine ständige Überwachung mit MRTs (unter anderem) erfordert, was die Kosten erheblich erhöht und die medizinischen Systeme unter Druck setzt.
Die Zulassung wird auch als Glücksfall für Biogen gesehen, dessen Aktien um mehr als 50 % stiegen, während die Aktien des japanischen Partners Eisai Co um 56 % zulegten. Analysten gehen davon aus, dass Aduhelm einen Umsatz von etwa 10 Mrd. USD erzielen könnte, wenn man bedenkt, dass allein in den USA 6 Millionen Menschen an Alzheimer erkrankt sind. Das Medikament ist wichtig für das Wachstum von Biogen, da die Konkurrenz den Umsatz ihrer Medikamente - Tecfidera für Multiple Sklerose (MS) und Spinraza für spinale Muskelatrophie (SMA) - beeinträchtigt hat.
Spinraza ist ein weiteres Medikament im Portfolio von Biogen, das mit einem Listenpreis von 750.000 Dollar für das erste Behandlungsjahr und 375.000 Dollar pro Jahr danach sehr teuer ist.
Nicht jeder steht der Entscheidung der FDA, Aduhelm zuzulassen, kritisch gegenüber
Da es sich bei Alzheimer um eine fortschreitende Krankheit handelt, müssen die Patienten eher früher als später behandelt werden. Die Nachricht von der FDA-Entscheidung hat vielen neue Hoffnung gegeben, entweder dass die Behandlung für sie selbst oder für ihre Angehörigen funktioniert, oder dass sie andere Unternehmen anspornt, andere Alzheimer-Behandlungen zu entwickeln.
Patientenorganisationen hatten sich vehement für die Zulassung eingesetzt, da es nur sechs andere Behandlungen für die schwächende Krankheit gibt, die nur die Symptome für einige Monate lindern. Im November 2020 stimmte der beratende Ausschuss der FDA gegen die Zulassung von Aduhelm, was bei der Alzheimer-Vereinigung zunächst Wut und dann Aktionen auslöste, die daraufhin ihre Unterstützung für das Potenzial des Medikaments zum Ausdruck brachten und die Notwendigkeit von Hoffnung und Fortschritt betonten.
Im Januar 2021 trafen sich die FDA und Patientengruppen zu einer Anhörung, bei der sich Patienten, Pflegekräfte, Kliniker und Befürworter für die Behandlung aussprachen und unter anderem argumentierten, dass es sich die Patienten nicht leisten können, noch länger auf eine Behandlung zu warten.
Der Direktor des FDA-Büros für neue Medikamente, Peter Stein, bestätigte auf einer Pressekonferenz, dass die Meinung der Patienten eine Rolle spielte. Er sagte, die FDA habe "sehr deutlich von den Patienten gehört, dass sie bereit sind, eine gewisse Unsicherheit in Kauf zu nehmen, um Zugang zu einem Medikament zu erhalten, das einen bedeutenden Nutzen bei der Verhinderung des Fortschreitens dieser Krankheit bieten könnte, die, wie wir alle wissen, sehr verheerende Folgen haben kann".
Patrizia Cavazzoni, die amtierende Direktorin des FDA-Zentrums für Arzneimittelevaluierung und -forschung, sagte auf derselben Pressekonferenz, dass "die Daten dafür sprechen, dass Patienten und Betreuer die Wahl haben, dieses Medikament zu verwenden".
"Diese FDA-Zulassung läutet eine neue Ära in der Alzheimer-Behandlung und -Forschung ein", sagte Dr. Maria Carrillo, Chief Science Officer der Alzheimer's Association. "Die Geschichte hat uns gezeigt, dass die Zulassung des ersten Medikaments in einer neuen Kategorie das Feld belebt, die Investitionen in neue Behandlungen erhöht und zu mehr Innovation anregt."
Wann wird Aduhelm in Europa zugelassen?
Die Alzheimer-Krankheit entwickelt sich immer mehr zu einer der größten medizinischen, wirtschaftlichen und sozialen Krisen des Jahrhunderts - und zu einer Krankheit, die nur schwer frühzeitig erkannt werden kann, zumal es in Europa an Spezialisten fehlt, die eine Diagnose bestätigen können. Allein in Europa leiden 2018 9,7 Millionen Menschen an der Alzheimer-Krankheit und anderen Formen der Demenz; bis 2030 wird die Zahl der Patienten voraussichtlich auf 14 Millionen ansteigen, so dass ein dringender Bedarf an wirksamen Behandlungen besteht.
Aduhelm ist außerhalb der Vereinigten Staaten noch nicht zugelassen worden. Biogen hat die Prüfung durch die Behörden in der Europäischen Union im Oktober 2020 sowie in Japan, Kanada, Australien und Brasilien Ende des Jahres 2020 beantragt.
Nach Angaben der Europäischen Arzneimittel-Agentur (EMA) dauert die Beurteilung eines Zulassungsantrags für ein neues Medikament in der Regel etwa ein Jahr, weniger, wenn der Entwickler des Medikaments eine beschleunigte Beurteilung erhält.
Im März dieses Jahres erhielt die 2-Milliarden-Dollar-Produktionsanlage von Biogen in der Schweiz eine GMP-Lizenz (Good Manufacturing Practice) vom Schweizerischen Heilmittelinstitut (Swissmedic). Biogen plant, Ende 2021 die FDA-Zulassung für die Produktion von Aduhelm in der Schweizer Anlage zu beantragen und rechnet damit, das Medikament an mehr als 1 Million Patienten pro Jahr zu liefern.
Zugang zu Aduhelm außerhalb der Vereinigten Staaten
Aduhelm ist derzeit von der FDA zugelassen und für Einwohner der Vereinigten Staaten erhältlich - und es gibt Vorschriften, die die Einfuhr von Medikamenten in Länder erlauben, in denen sie derzeit nicht zugelassen sind.
Patienten mit lebensbedrohlichen oder zu Invalidität führenden Krankheiten haben das Recht auf Zugang, Kauf und Einfuhr von Arzneimitteln mit Hilfe ihrer behandelnden Ärzte.
Patienten und ihre Ärzte können dies auf der Grundlage der "compassionate use"- oder "named patient import"-Regelungen tun, einer gesetzlichen Ausnahme von der allgemeinen Regel, dass ein Arzneimittel normalerweise erst nach der Marktzulassung/Zulassung (welche Formulierung wir auch immer verwenden) in dem Land, in dem der Patient lebt, erhältlich ist. Diese Ausnahme ermöglicht es Patienten, auf legale, ethische und sichere Weise Zugang zu Arzneimitteln zu erhalten, die in ihrem Land noch nicht zugelassen sind.
Mehr über die "named patient basis" erfahren Sie hier (EMA).
everyone.org setzt sich dafür ein, dass Patienten und ihre behandelnden Ärzte Zugang zu allen weltweit verfügbaren Medikamenten für die bestmögliche Behandlung haben. Wenn Sie sich außerhalb der Vereinigten Staaten befinden, arbeiten wir 100%ig konform mit den Vorschriften Ihres Landes. Wenn Sie weitere Einzelheiten lesen, auf das Medikament zugreifen oder unser Support-Team kontaktieren möchten , können Sie dies hier tun.
Wie viel kostet Aduhelm ?
Biogen hat bekannt gegeben, dass die Kosten für Aduhelm in der Erhaltungsdosis (10 mg/kg) für einen durchschnittlichen Patienten 56.000 Dollar pro Jahr betragen würden. Darin sind die Tests nicht enthalten, die die Patienten vor und während der Behandlung durchführen müssen.
Biogen wurde wegen des hohen Preises des Medikaments pro Jahr kritisiert.
Das gemeinnützige Institute for Clinical and Economic Review (ICER), das die Preise von Medikamenten analysiert, gab an, dass ein angemessener jährlicher Preis zwischen 2.500 und 8.300 Dollar pro Patient und Jahr liegen würde. In einer Erklärung sagte ICER, dass die FDA-Zulassung die Patienten nicht schützt und Biogen mehr als 50 Milliarden Dollar pro Jahr einnehmen könnte, "selbst wenn man auf den Nachweis wartet, dass die Patienten tatsächlich von der Behandlung profitieren".
Der Vorstandsvorsitzende von Biogen, Michel Vounatsos, hat auf die Kritik mit der Behauptung reagiert, dass der Preis des Medikaments durch den Nutzen gerechtfertigt sei, den es für die Patienten und eine durch Alzheimer weniger belastete Gesellschaft bringe, und dass der Preis ein Spiegelbild von "zwei Jahrzehnten ohne Innovation" sei. "Es ist an der Zeit, in die Behandlung zu investieren", fügte er hinzu.
Wir von everyone.org können den von Biogen festgelegten Preis nicht beeinflussen. Wir sind in der Lage, Patienten den Zugang zu Aduhelm zu den folgenden Preisen zu ermöglichen:
- 1.958,58 € für ein Fläschchen mit 170 mg/1,7 mL (100 mg/mL)
- 3.046,68 € für ein Fläschchen mit 300 mg/3 mL (100 mg/mL)
Stellen Sie hier eine Anfrage für weitere Informationen.
Zukünftige Behandlungen für die Alzheimer-Krankheit
Aus einer im Mai 2021 veröffentlichten Studie geht hervor, dass derzeit 126 Behandlungenfür die Alzheimer-Krankheit in der klinischen Prüfungsind. 82,5 % davon zielen auf eine Veränderung der Krankheit ab, 10,3 % verbessern die Kognition und 7,1 % konzentrieren sich auf die Linderung neuropsychiatrischer Symptome.
- Phase-3-Studien: 28 Behandlungen (einschließlich Aducanumab)
- Phase-2-Studien: 74 Behandlungen
- Phase-1-Studien: 24 Behandlungen
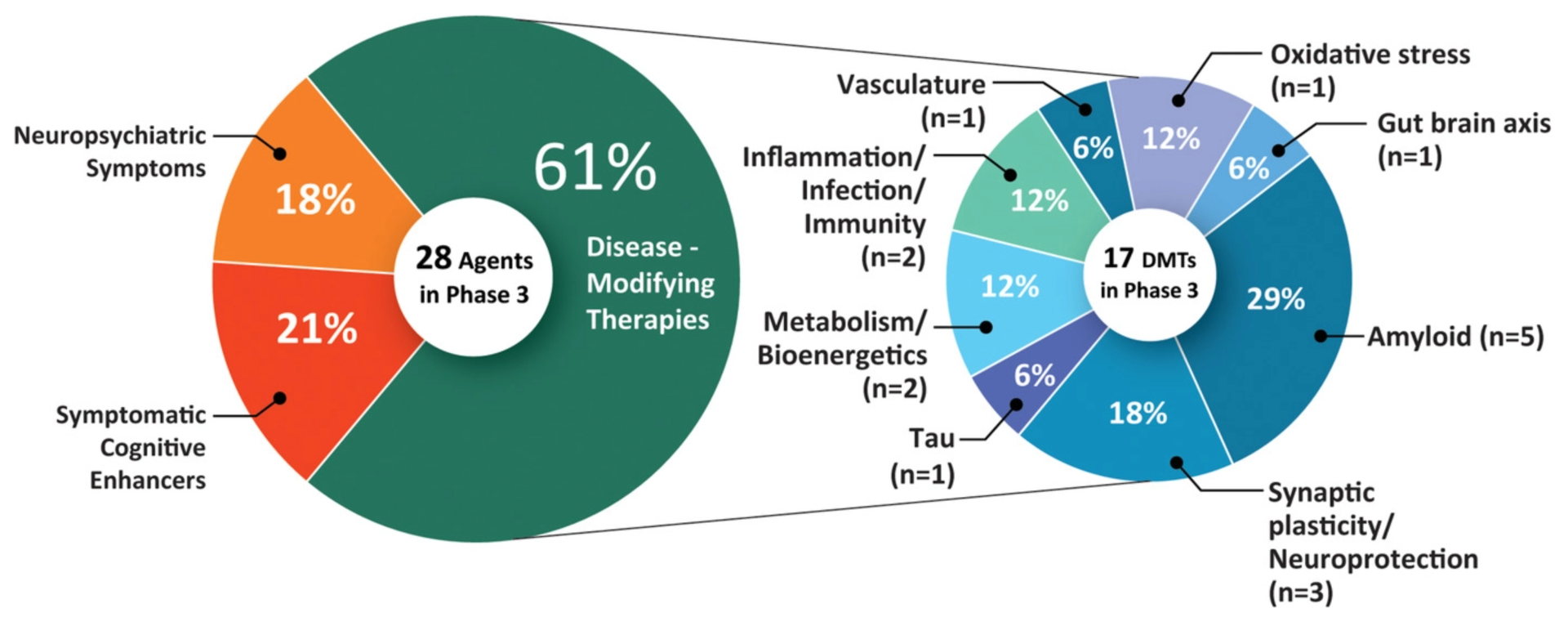
Die Behandlungen, die sich in Phase-3-Studien befinden, werden höchstwahrscheinlich im kommenden Jahr zugelassen werden.
Lecanemab
Der monoklonale Antikörper Lecanemab, der ähnlich wie Aducanumab wirkt (indem er das Immunsystem zur Beseitigung von Beta-Amyloid-Plaques anregt), ist den veröffentlichten Berichten zufolge vielversprechend und hat die klinische Phase 3 erreicht.
Gantenerumab
Gantenerumab bindet an Beta-Amyloid, und zwar insbesondere an Beta-Amyloid-Plaques im Vergleich zum einzelnen Beta-Amyloid, das im Blut zirkuliert. Man nimmt an, dass es Amyloid-Plaques auflöst und Beta-Amyloid entfernt, indem es die Phagozytose stimuliert, einen Prozess, bei dem eine Zelle ein bestimmtes Molekül in sich aufnimmt und verdaut. Frühere klinische Studien mit Gantenerumab haben gezeigt, dass es die Beta-Amyloid-Plaques bei Menschen mit der häufigeren Form der Alzheimer-Krankheit, die nicht direkt durch Genmutationen verursacht wird, reduziert. Gantenerumab wird weiterhin in zwei großen globalen Phase-III-Studien untersucht.
Solanezumab
Solanezumab ist ein Antikörper, der darauf abzielt, Beta-Amyloid aus dem Blut und der Gehirn-Rückenmarks-Flüssigkeit zu "reinigen" und so die Bildung von Plaques zu verhindern. Vorteile wurden von Teilnehmern berichtet, die über den gesamten Zeitraum von dreieinhalb Jahren an den Studien teilnahmen, und weniger von Teilnehmern, die später hinzukamen, so dass es noch mehr über die Wirkung zu lernen gibt.
Donanemab
Donanemab scheint ein weiteres vielversprechendes neues Medikament zur Behandlung der Alzheimer-Krankheit zu sein. Es wird von Eli Lilly and Company getestet. Das Unternehmen plant, 1500 Teilnehmer in eine große Studie einzuschließen, um die Ergebnisse einer kleineren Studie zu bestätigen. Diese frühere Studie dauerte 76 Wochen und umfasste 257 Patienten, und den Berichten zufolge zeigte sich, dass Donanemab das Fortschreiten der Alzheimer-Krankheit deutlich verlangsamt.
Andere
Saracatinib ist ein experimenteller Wirkstoff, der als Inhibitor eines Proteins namens Fyn-Kinase wirkt, das die Bildung von Beta-Amyloid-Plaques fördert. Eine an Mäusen durchgeführte Studie hat gezeigt, dass Saracatinib durch die Hemmung der Fyn-Kinase den Gedächtnisverlust bei Mäusen wirksam umkehren kann. Die Hemmung der Fyn-Kinase kann das Fortschreiten der Krankheit verhindern oder verzögern.
Forscher am Salk Institute for Biological Studies in Kalifornien untersuchen eine Chemikalie namens Fisetin und entwickelten eine Version von Fisetin mit der Bezeichnung CMS121, die sich als wirksam bei der Verlangsamung des Verlusts von Gehirnzellen erwiesen hat. Es sind noch weitere Forschungsarbeiten erforderlich, bevor ein Medikament zugelassen werden kann.
Maria Carrillo, Chief Science Officer der Patientenvereinigung Alzheimer's Association in Chicago, USA, sagte in einer Stellungnahme für Nature über die jüngste Zulassung von Aduhelm: "Wir sind hoffnungsvoll, und dies ist der Anfang - sowohl für dieses Medikament als auch für bessere Behandlungen der Alzheimer-Krankheit."
"Alles, was wir wirklich sind, sind unsere Gedanken und unser Gehirn". - Sandy, ehemalige Zahnärztin, Assistenzprofessorin und Alzheimer-Patientin.
Wir von everyone.org sind davon überzeugt, dass die Wissenschaft die Menschheit voranbringt und Leben verbessert oder sogar rettet. Die Alzheimer-Krankheit bedroht die Lebensqualität vieler Menschen. Wir ermutigen die Wissenschaftler, die sich der Suche nach einer (Teil-)Lösung verschrieben haben, weiterzumachen, und wir hoffen, dass die in der Entwicklung befindlichen Behandlungen, die vielversprechende Ergebnisse zeigen, in den nächsten drei Jahren zugelassen und für Alzheimer-Patienten in aller Welt zugänglich werden.