Was sind die neuesten Immuntherapien für Gebärmutterhalskrebs, und wie kann man sie in Polen sofort einsetzen?


Was sind die neuesten Immuntherapien für Gebärmutterhalskrebs, und wie kann man sie in Polen sofort einsetzen?


Wann wird das neuste Alzheimer-Medikament für Patienten in der Schweiz verfügbar sein (und wie man es früher bekommt)?


Ist das neue Alzheimer-Medikament für Schweizer Patientinnen und Patienten erhältlich, und wie kann man es bekommen?


Ein neues wirksames und sicheres Medikament zur Senkung der Triglyceride bei FCS-Patienten ist jetzt verfügbar. Aber wann wird es für Sie verfügbar sein?

Wann wird das erste zugelassene Medikament gegen Fettleber mit Fibrose in Europa und im Vereinigten Königreich verfügbar sein?


Wann wird das neue Medikament gegen COPD für Patienten in Europa und im Vereinigten Königreich verfügbar sein (und wie man nicht warten muss)?

Wann wird die erste zielgerichtete Therapie für CLDN 18.2-positiven Magen- und GEJ-Krebs für Patienten in Europa verfügbar sein?

Wann wird die erste zielgerichtete Therapie für akute Leukämie mit KMT2A-Translokation außerhalb der USA verfügbar sein?

Wann wird das erste Medikament gegen NPC für Patienten in Europa, dem Vereinigten Königreich und darüber hinaus verfügbar sein (und wie man nicht warten muss)?


Wann wird die erste zielgerichtete Therapie für HER2-exprimierende BTC zugelassen? Alles über den Zeitplan und Ihre Möglichkeiten in der Zwischenzeit.


Alle sicheren und legalen Optionen für den Zugang zu Leqembi, während es auf seine EU-Zulassung wartet.

Im Folgenden finden Sie einen Überblick über die einzelnen Arzneimittel, um Ihnen und Ihrem Arzt bei der Entscheidung über die Behandlung von Mukoviszidose zu helfen: 
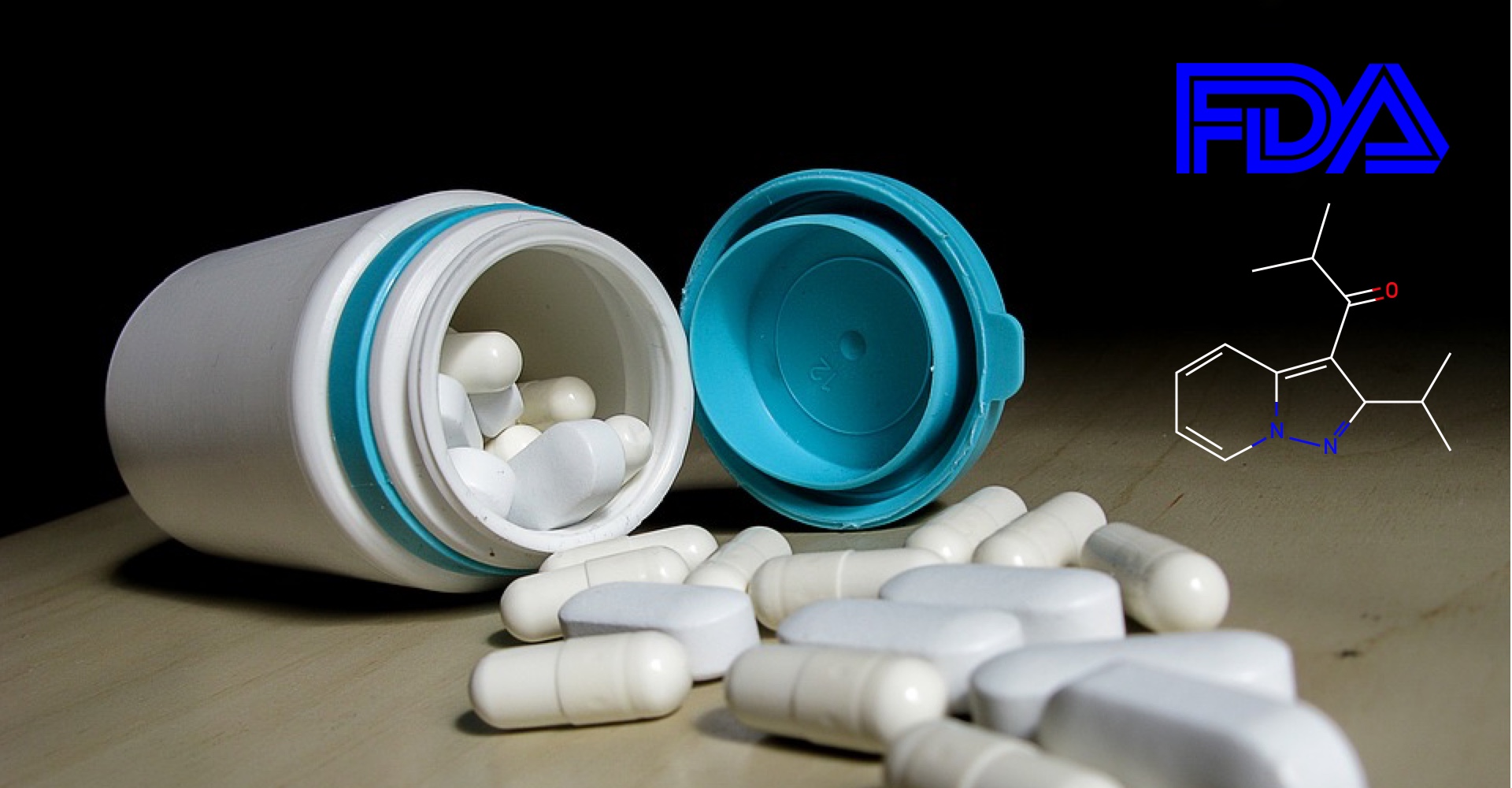
Kyowa Hakko Kirins Parkinson-Therapie, Nourianz istradefylline, erhält die FDA-Zulassung als Zusatztherapie zu levodopa.

Radicutedaravone), das nachweislich das Fortschreiten der ALS verlangsamt, ist jetzt für Patienten in China zugelassen.

Orkambi und Symkevi wurden vom Scotland Medicines Consortium (SMC) mit der Begründung abgelehnt, dass die Kosten den Nutzen überwiegen.

Vitrakvi larotrectinib) vom CHMP zur Zulassung in der EU empfohlen.

Neues Hautkrebsmedikament jetzt in der EU für Erwachsene mit metastasiertem oder lokal fortgeschrittenem Plattenepithelkarzinom der Haut zugelassen.

Vyndaqel tafamidis) ist jetzt in den USA zugelassen, nachdem eine Studie eine höhere Überlebensrate und eine geringere Krankenhausdauer aufgrund von Herzproblemen gezeigt hat.

Die Genehmigung für die nächste Phase der klinischen Studien bringt ALS-Patienten einen Schritt näher an eine neue Behandlung heran, die das Fortschreiten der Krankheit nachweislich verlangsamt.
Aufgrund vielversprechender Ergebnisse aus klinischen Studien der Phase III hat Health Canada beschlossen, die Anwendung von Kalydeco (Ivacaftor) auf Kinder im Alter von 1 bis 2 Jahren auszuweiten.

Eine kürzlich durchgeführte klinische Studie zeigt, dass Symdeko (Tezacaftor/Ivacaftor) zähen, klebrigen Schleim bei Kindern im Alter von 6-11 Jahren sicher und wirksam lösen kann.

Phase-III-Studie zeigt, dass Copiktra duvelisib) eine Option für Patienten mit rezidivierender oder refraktärer chronischer lymphatischer Leukämie und kleinem lymphatischem Lymphom sein kann.

Onpattro (Patisiran) ist das erste Medikament seiner Klasse, das das Fortschreiten der hereditären Transthyretin-Amyloidose (hATTR) verlangsamt.

Neues Medikament zeigt statistisch signifikante Verbesserungen für Prostatakrebspatienten.

Australien bietet Erstattungen für Mukoviszidose-Medikamente an.

Die Europäische Kommission hat Alunbrig brigatinib) für die Behandlung einer bestimmten Art von Lungenkrebs zugelassen.

 Den Studienleitern zufolge könnte etwa ein Drittel der Patienten von dieser Therapie profitieren, die Remissionen ermöglichen, Symptome lindern und Leben retten kann.
Den Studienleitern zufolge könnte etwa ein Drittel der Patienten von dieser Therapie profitieren, die Remissionen ermöglichen, Symptome lindern und Leben retten kann.
2018 war ein gutes Jahr für neue Krebstherapien, sagt die amerikanische AACR. 
 Kisqali ist jetzt der einzige CDK4/6-Hemmer, der in den USA zusammen mit einem Aromatasehemmer zur Behandlung prä-, peri- oder postmenopausaler Frauen eingesetzt werden kann.
Kisqali ist jetzt der einzige CDK4/6-Hemmer, der in den USA zusammen mit einem Aromatasehemmer zur Behandlung prä-, peri- oder postmenopausaler Frauen eingesetzt werden kann.