Ist dostarlimab in Belgien verfügbar (und was ist in der Zwischenzeit zu tun)?
Zuletzt aktualisiert: 15. Januar 2024

Sie können legal Zugang zu neuen Arzneimitteln erhalten, auch wenn diese in Ihrem Land nicht zugelassen sind.
Erfahren Sie, wieDostarlimab (im Handel erhältlich unter Jemperli) ist eine neuartige Anti-PD-1-Therapie. Sie erhielt 2021 von der EMA eine bedingte Zulassung für die Behandlung von fortgeschrittenem oder rezidivierendem Endometriumkarzinom [1]. Damit ist es die erste Anti-PD-1-Therapie, die in Europa für diese Indikation zugelassen ist.
Für Patienten mit Mismatch-Reparatur-defizienten (dMMR) Tumoren ist dies ein großer Meilenstein. Zumal die Innovation in diesem Bereich laut Jack Harris, Vice-President UK Oncology bei GSK, hinterherhinkt [2].
Diejenigen, die mit der Behandlung mit dostarlimab in Belgien beginnen möchten, müssen sich jedoch möglicherweise noch etwas gedulden. Es kann noch einige Zeit dauern, bis das Medikament auf dem Markt erhältlich ist.
Ist dostarlimab in Belgien verfügbar?
Derzeit ist dostarlimab auf dem belgischen Markt nicht weit verbreitet.
Nach der bedingten Marktzulassung im Jahr 2021 war dostarlimab in Belgien im Rahmen von zwei Compassionate-Use-Programmen erhältlich:
- Eines davon konzentrierte sich auf dostarlimab als Einzelwirkstoff zur Behandlung von rezidivierendem oder fortgeschrittenem dMMR/MSI-H-Endometriumkrebs, der nach einer früheren Behandlung fortgeschritten ist. Dieses Programm wurde im Jahr 2022 abgeschlossen [3].
- Eines davon konzentrierte sich auf dostarlimab in Kombination mit Chemotherapie als Erstlinienbehandlung von primärem fortgeschrittenem oder rezidivierendem dMMR/MSI-H-Endometriumkrebs. Dieses Programm ist derzeit noch aktiv [3].
Dostarlimab hat noch eine weitere von der FDA zugelassene Indikation, die Behandlung von dMMR/MSI-H bei fortgeschrittenen oder wiederkehrenden soliden Tumoren. Für diese Indikation ist es derzeit nicht von der EMA zugelassen und in Belgien nicht erhältlich.
Wann wird dostarlimab in Belgien verfügbar sein?
Die Erteilung der vollständigen Zulassung durch die EMA (voraussichtlich 2024) wird der erste Schritt zur Verfügbarkeit von dostarlimab auf dem belgischen Markt sein. Wenn es von der FAMHP für die Aufnahme in den Versorgungspfad genehmigt wird, müssen auch Entscheidungen über die lokale Preisgestaltung und die Kostenübernahme durch die Krankenkassen getroffen werden.
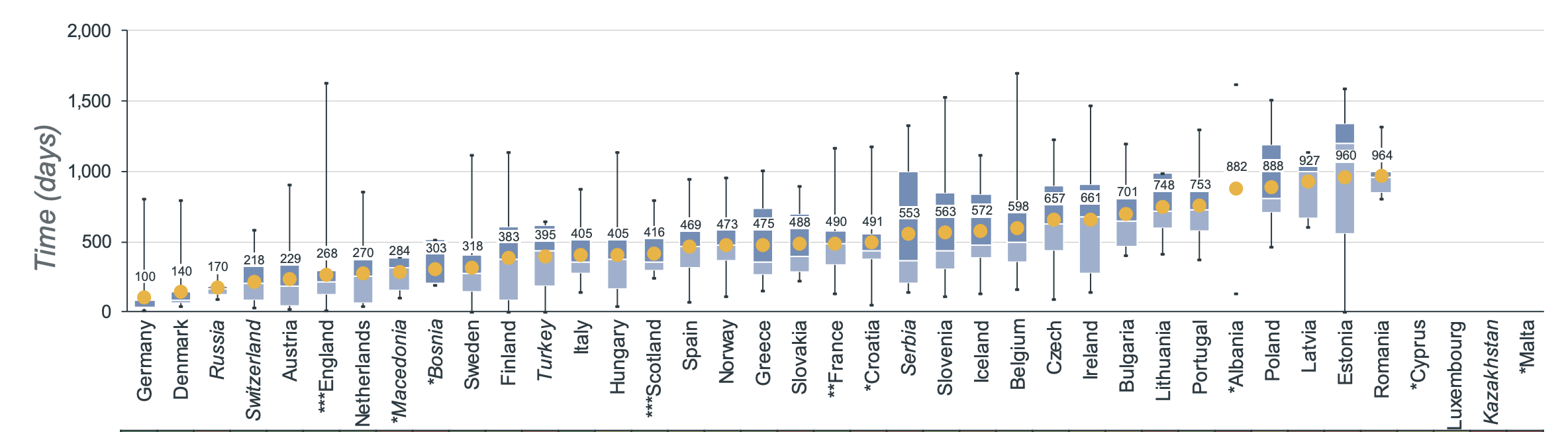
Die durchschnittliche Zeitspanne zwischen der EMA-Zulassung eines Arzneimittels und seiner Verfügbarkeit auf dem Markt ist von Land zu Land sehr unterschiedlich. Der europäische Durchschnitt für onkologische Behandlungen lag im Jahr 2022 bei 511 Tagen zwischen der EMA-Zulassung und dem Datum der breiten Verfügbarkeit. In Belgien beträgt die durchschnittliche Zeit bis zur Verfügbarkeit 598 Tage [4].
In diesem Zusammenhang könnte es noch einige Zeit dauern, bis dostarlimab auf dem belgischen Markt weithin verfügbar ist.

Was können Sie tun, bis dostarlimab nach Belgien kommt?
Sind Sie eine Patientin in Belgien mit Endometriumkrebs, die nicht für das Compassionate Use Programm in Frage kommt? Oder sind Sie eine Patientin mit einem fortgeschrittenen soliden dMMR/MSI-H-Tumor? Wenn Ihr Arzt eine Behandlung mit dostarlimab empfiehlt, haben Sie mehrere Möglichkeiten.
Wenn ein Medikament im Land eines Patienten nicht zugelassen ist oder zwar zugelassen, aber noch nicht verfügbar ist, können Sie es über die Verordnung über die Einfuhr für benannte Patienten abrufen.
Everyone.org ist darauf spezialisiert, den Zugang zu den neuesten Medikamenten über diese Verordnung zu erleichtern. Wenn Sie von Ihrem behandelnden Arzt ein Rezept für Jemperli (dostarlimab) erhalten haben, es kaum erwarten können, mit der Behandlung zu beginnen, und wir Ihnen helfen sollen, sofort Zugang zu dem Medikament zu erhalten, kontaktieren Sie uns.
Referenzen:
- Jemperli | Europäische Arzneimittel-Agentur. Europäische Arzneimittel-Agentur, 21. April 2021.
- Cooper, Emma. Britische Patientinnen erhalten frühen Zugang zu GSKs Endometriumkrebstherapie. Pf Media, 10. Juli 2023.
- Compassionate use - Medizinische Notwendigkeit. FAMHP, Zugriff am 25. September 2023.
- EFPIA Patienten W.A.I.T. Indikator 2021 Umfrage. EFPIA, Zugriff am 25. September 2023.