Wann wird Vamorolone in Europa und im Vereinigten Königreich erhältlich sein? Die ganze Geschichte.
Zuletzt aktualisiert: 16. April 2024

Sie können legal Zugang zu neuen Arzneimitteln erhalten, auch wenn diese in Ihrem Land nicht zugelassen sind.
Erfahren Sie, wieKortikosteroide sind seit vielen Jahren eine Standardbehandlung für Patienten mit Duchenne-Muskeldystrophie. In der Regel werden sie im Alter von 4 oder 5 Jahren in den Behandlungsplan aufgenommen, bevor sie in die "Plateauphase" eintreten und einen erheblichen Kraftverlust erleiden 1. Leider kann die langfristige Einnahme von Kortikosteroiden mit verschiedenen Nebenwirkungen verbunden sein, darunter Verhaltensstörungen, Gewichtszunahme, Osteoporose und mehr 2.
In diesem Zusammenhang ist die kürzliche FDA-Zulassung von Agamree (Vamorolon) als "Kortikosteroid der neuen Generation" mit weniger Nebenwirkungen ein dringend benötigter Durchbruch in der Duchenne-Behandlung gewesen.
Während Vamorolon in den USA bereits im ersten Quartal 2024 in den Apotheken erwartet wird, ist es in anderen Ländern noch nicht zugelassen.
Wann wird Vamorolon in Europa und im Vereinigten Königreich erhältlich sein? Hier finden Sie alles, was Sie wissen müssen.
Wofür wird Vamorolon verwendet?
Agamree (Vamorolon) ist für die Behandlung von Kindern (4+) und Erwachsenen mit Duchenne-Muskeldystrophie angezeigt.
Agamree ist ein dissoziatives Kortikosteroid. Es wirkt hauptsächlich durch die Beruhigung von Entzündungen im Körper. Vamorolon wirkt ähnlich wie andere Kortikosteroide. Es lagert sich jedoch anders an die Zellen an und löst nicht wie andere Steroide bestimmte Körperreaktionen aus.
Es ist noch nicht vollständig geklärt, wie Vamoloron bei DMD (Duchenne-Muskeldystrophie) wirkt. Die Ergebnisse klinischer Studien deuten jedoch darauf hin, dass es Kindern mit dieser Krankheit hilft, schneller aus dem Liegen aufzustehen und besser zu gehen. Zu den üblichen Nebenwirkungen gehören geschwollenes Aussehen, Erbrechen, Gewichtszunahme und Launenhaftigkeit 3.
Ist Vamorolon von der EMA zugelassen?
Seit Dezember 2023 ist Agamree (Vamorolon) von der EMA für die Behandlung von Duchenne-Muskeldystrophie bei Erwachsenen und Kindern über 4 Jahren zugelassen .
Wann wird Vamorolon in Europa erhältlich sein?
Obwohl die EMA-Zulassung von Vamorolon eine gute Nachricht ist, bedeutet sie nicht, dass das Medikament sofort in allen europäischen Ländern erhältlich sein wird. Bevor es in die Apotheken kommt, müssen der Hersteller des Medikaments und die lokalen Gesundheitsbehörden der einzelnen Mitgliedstaaten Entscheidungen über die lokale Zulassung, die Preise und den Krankenversicherungsschutz treffen. Daher wird Vamorolon wahrscheinlich in jedem europäischen Land zu einem anderen Zeitpunkt verfügbar sein.
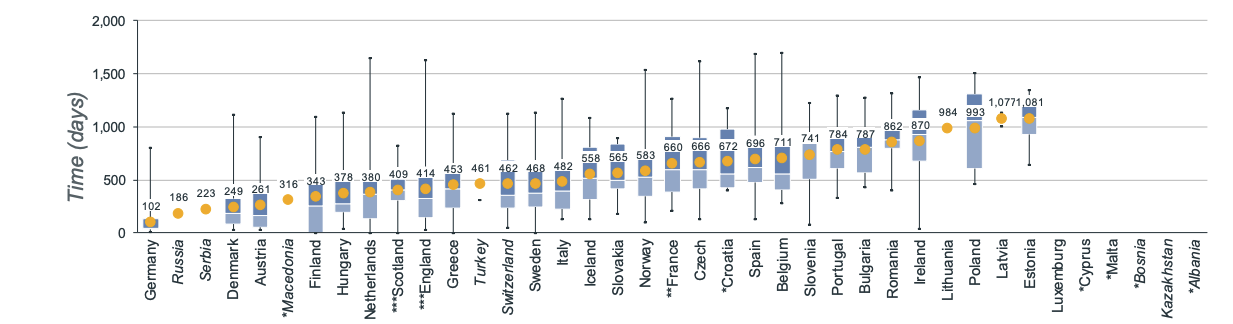
Es dauert im Durchschnitt 511 Tage nach der EMA-Zulassung, bis neue Arzneimittel in der EU verfügbar sind. Diese Zeitspanne ist von Land zu Land sehr unterschiedlich. Bei Arzneimitteln für seltene Leiden wie Vamorolon reicht sie von 102 Tagen in Deutschland bis zu 1 081 Tagen in Estland 5.
Wann wird Vamorolon im Vereinigten Königreich erhältlich sein?
Nach der Zulassung durch die EMA wurde Vamorolin nun auch von der MHRA im Vereinigten Königreich zugelassen. Damit ist das Medikament die erste Duchenne-Behandlung, die im Vereinigten Königreich, in der EU und in den USA gemeinsam zugelassen wurde.
Bevor Vamorolon im NHS verfügbar ist, muss das NICE seine Entscheidung zu diesem Thema überprüfen und veröffentlichen. Die Konsultationen sind im Gange, und ein Entwurf der Leitlinien wird für Ende April 2024 erwartet6 . Sollte dieser positiv ausfallen, dürfte Agamree innerhalb von drei Monaten nach dem Datum des NICE-Beschlusses für Patienten verfügbar sein.
Zulassungsstatus von Vamorolon in der übrigen Welt
Ab April 2024 ist Agamree (Vamorolon) nirgendwo sonst auf der Welt für die Behandlung von Duchenne-Muskeldystrophie 7 zugelassen.

Wie Sie sicher auf Agamree (Vamorolon) zugreifen können, bevor es in Ihrem Land zugelassen wird
Sind Sie ein Duchenne-Patient außerhalb der USA? Wenn Ihr Arzt der Meinung ist, daß Vamorolon Ihnen helfen könnte, müssen Sie vielleicht nicht auf die Zulassung oder Verfügbarkeit von Agamree vor Ort warten. Stattdessen könnten Ihr Arzt und Sie klinische Studien mit Vamorolon erkunden. Oder Sie können Vamorolon sofort als namentlich benannter Patient kaufen.
An einer klinischen Studie mit Vamorolon teilnehmen
Sie können an einer klinischen Studie teilnehmen, um Agamree (Vamorolon) oder andere nicht zugelassene Arzneimittel zu erhalten. Es kann schwierig sein, eine Studie in Ihrem Land zu finden, die Teilnehmer rekrutiert, aber es ist möglich. Um an der Studie teilnehmen zu können, müssen Sie die Zulassungskriterien erfüllen. Außerdem benötigen Sie die Unterstützung Ihres behandelnden Arztes.
Hier sind einige gute Anlaufstellen für die Suche nach laufenden klinischen Studien mit Vamorolon:
- ClinicalTrials.gov: Dies ist eine Datenbank mit allen klinischen Studien in den USA. Einige der Studien sind auch für internationale Teilnehmer offen. Ein Beispiel ist die klinische Studie NCT05185622 mit Vamorolon, für die Patienten in Kanada rekrutiert werden 8.
- EUClinicaltrials.eu: Diese Datenbank enthält alle klinischen Prüfungen in der Europäischen Union. Derzeit enthält sie nur begrenzte Informationen über Studien, die vor dem 31. Januar 2022 begonnen wurden. Für diese Studien können Sie auf das EU-Register für klinische Studien zurückgreifen.
- myTomorrows: Diese Organisation unterstützt Patienten bei der Suche nach Behandlungsmöglichkeiten in klinischen Studien.
Vamorolon auf der Basis eines individuell benannten Patienten kaufen
In den meisten Ländern ist es Patienten gesetzlich erlaubt, Arzneimittel zu kaufen und zu importieren, die ihr Leben verbessern oder lebensbedrohliche Krankheiten behandeln können. Wenn Sie sich Zugang zu Vamorolon verschaffen möchten, bevor es in Ihrem Land verfügbar ist, könnte dies eine Möglichkeit für Sie und Ihren Arzt sein.
Die Verordnung, die dies ermöglicht, ist bekannt als die Verordnung über die Einfuhr personenbezogener Daten von Patienten. Die spezifischen administrativen Anforderungen können von Land zu Land unterschiedlich sein. In allen Fällen müssen diese Kriterien jedoch erfüllt werden:
-
Das betreffende Arzneimittel ist in einem anderen Land zugelassen und im Land des Patienten (noch) nicht zugelassen oder verfügbar;
-
Auf dem lokalen Markt gibt es keine Alternative;
-
Das Arzneimittel ist für den persönlichen Gebrauch bestimmt;
-
Der Patient verfügt über eine Verschreibung seines behandelnden Arztes;
-
Der Arzt übernimmt die Verantwortung für die Behandlung. Dies kann von Land zu Land unterschiedliche Unterlagen erfordern.
Möchten Sie die Verordnung über die individuelle Einfuhr für namentlich benannte Patienten nutzen, um Vamorolon zu erhalten, bevor es in Europa, im Vereinigten Königreich oder anderswo allgemein verfügbar ist? Sie müssen zunächst Ihren behandelnden Arzt konsultieren und sich ein entsprechendes Rezept ausstellen lassen.
Sie haben bereits ein Rezept? Unser Team kann Sie beim sofortigen Kauf von Vamorolon unterstützen.
Referenzen:
- Steroide (Kortikosteroide). Elternprojekt Muskeldystrophie, abgerufen am 13. November 2023.
- Side Effects of Long Term High-Dose Steroid Therapy, abgerufen am 13. November 2023.
- Agamree: Zugelassen | Europäische Arzneimittel-Agentur. Europäische Arzneimittel-Agentur, 13. Oktober 2023.
- Beantragung der EU-Zulassung für Humanarzneimittel. Europäische Arzneimittelagentur, Zugriff am 13. November 2023.
- EFPIA Patienten W.A.I.T. Indikator 2021 Umfrage. Efpia, Zugriff am 13. November 2023.
- Projektinformation | Vamorolon zur Behandlung der Duchenne-Muskeldystrophie [ID4024] | Guidance. NICE, Zugriff am 13. November 2023.
- AGAMREE® (Vamorolon) - santhera. Santhera, Zugriff am 13. November 2023.
- A Study to Assess Vamorolone in Boys Ages 2 to <4 Years and 7 to <18 Years With Duchenne Muscular Dystrophy (DMD). ClinicalTrials.gov, Accessed 13 November 2023.




