Adakveo vs Oxbryta: Lernen Sie Ihre crizanlizumab Alternativen kennen
Zuletzt aktualisiert: 15. Januar 2024
Sie können legal Zugang zu neuen Arzneimitteln erhalten, auch wenn diese in Ihrem Land nicht zugelassen sind.
Erfahren Sie, wie
Nachdem die Zulassung von Adakveo (crizanlizumab) in der EU widerrufen wurde, müssen viele Patienten und Ärzte eine Alternative zu Adakveo finden.
Wenn Sie gut auf Ihre Behandlung angesprochen haben, können Sie weiterhin Adakveo nutzen, auch wenn es in der EU nicht mehr zugelassen ist. Wenn Ihr Arzt es jedoch vorzieht, Ihre Behandlung zu ändern, ist es gut zu wissen, was dies für Sie als Patient bedeutet.
In diesem Artikel befassen wir uns mit einer der möglichen Adakveo Alternativen, die Ihr Arzt vielleicht besprechen möchte - Oxbryta (voxelotor). Hier finden Sie einen kurzen Überblick über die Gemeinsamkeiten und Unterschiede zwischen Adakveo und Oxbryta.
Adakveo vs Oxbryta: Wofür werden sie verwendet?
Sowohl Adakveo als auch Oxbryta sind verschreibungspflichtige Arzneimittel zur Behandlung der Sichelzellkrankheit 1,2. Jedes der Medikamente zielt jedoch auf einen anderen Aspekt der Krankheit ab.
Adakveo zielt darauf ab, die Häufigkeit schmerzhafter vasookklusiver Krisen zu verringern, während Oxbryta zur Behandlung der hämolytischen Anämie bei Sichelzellpatienten eingesetzt wird 1,2.
Für welches Alter ist Oxbryta in der EU zugelassen?
Im Gegensatz zu Adakveo, das nur bei Patienten ab 16 Jahren angewendet werden kann, ist Oxbryta auch für pädiatrische Patienten geeignet.
In den USA kann Oxbryta ab einem Alter von 4 Jahren verschrieben werden, während in der EU die pädiatrische Verwendung erst ab einem Alter von 12 Jahren zugelassen ist 1,2.
Crizanlizumab vs Voxelotor: Wie funktionieren sie?
Beide Medikamente zielen darauf ab, die Komplikationen der Sichelzellkrankheit zu verringern, aber sie zielen auf unterschiedliche Aspekte der Krankheit ab.
Adakveo und die Verringerung von schmerzhaften Krisen
Adakveo zielt darauf ab, die Häufigkeit von schmerzhaften Krisen zu verringern, die auftreten, wenn missgebildete Blutzellen in Blutgefäßen stecken bleiben.
Der Wirkstoff des Medikaments, crizanlizumab, ist ein spezieller Proteintyp, ein so genannter monoklonaler Antikörper. Dieses Protein ist so formuliert, dass es an P-Selektin bindet, eine Substanz, die sich auf der äußeren Schicht der Zellen befindet, die die Blutgefäße auskleiden.
P-Selektin hilft den Zellen, an den Blutgefäßen zu haften, und ist an den Gefäßverstopfungen während der schmerzhaften Episoden der Sichelzellkrankheit beteiligt. Durch Bindung an P-Selektin und Hemmung seiner Funktion soll Adakveo diese schmerzhaften Episoden verhindern 3.
Oxbryta und die Prävention von Anämie
Oxbrytazielt dagegen darauf ab, die mit der Sichelzellenkrankheit verbundene Anämie zu verhindern.
Der Wirkstoff in Oxbryta, voxelotor, verbessert die Fähigkeit des Hämoglobins, Sauerstoff zu binden, und verhindert, dass es in den Blutgefäßen starre Ketten bildet. Dies trägt dazu bei, dass die roten Blutkörperchen ihre normale Form und Flexibilität behalten. Außerdem wird die Rate ihrer vorzeitigen Zerstörung verringert und ihre Lebensdauer verlängert 4.
Wie effizient sind Adakveo und Oxbryta?
Die Wirksamkeit von Adakveo (crizanlizumab) und Oxbryta (voxelotor) wurde in klinischen Studien untersucht.
-
Adakveo Ergebnisse der klinischen Prüfung
AdakveoDie FDA-Zulassung sowie die erste Marktzulassung in der EU basierten auf den Ergebnissen der klinischen Studie SUSTAIN. In der Studie wurde Adakveo (mit oder ohne Hydoxyharnstoff) mit Placebo verglichen.
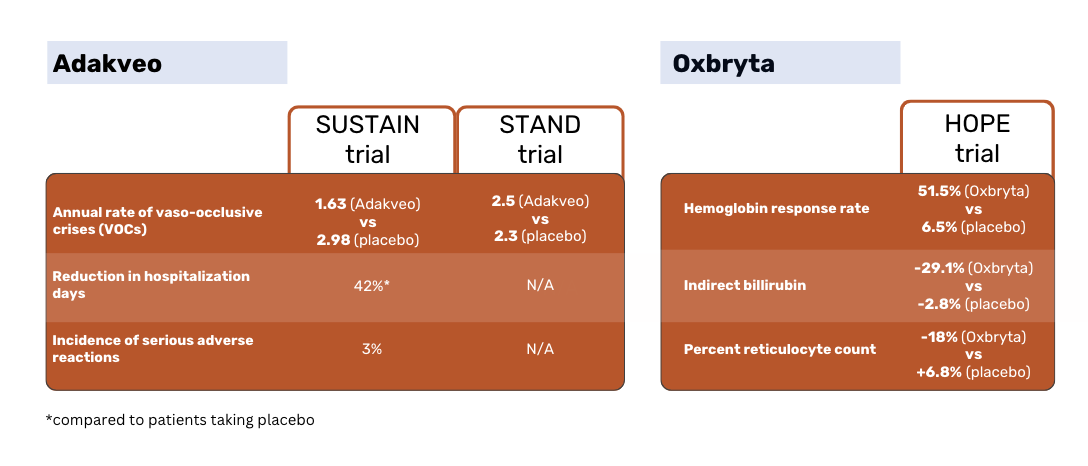
Den Ergebnissen der SUSTAIN-Studie zufolge hatten Patienten, die mit Adakveo behandelt wurden, eine statistisch signifikant niedrigere mediane jährliche Rate an vasookklusive Krisen (VOC) - 1,63 gegenüber 2,98 bei Placebo-Patienten. Bei 36 % der Patienten unter Adakveo traten während des 52-wöchigen Studienzeitraums keine VOCs auf, verglichen mit 17 % der Patienten unter Placebo 1.
Wie lauteten die Ergebnisse der Studie Adakveo STAND?
In der globalen Phase-3-Studie STAND, in der Adakveo erneut mit Placebo verglichen wurde, konnte kein statistisch signifikanter Unterschied in der Rate der VOCs zwischen den Patientengruppen nachgewiesen werden. Bei den mit Adakveo behandelten Patienten traten innerhalb eines Jahres durchschnittlich 2,5 schmerzhafte Krisen auf - kein signifikanter Unterschied zu den durchschnittlich 2,3 Krisen, die in der Placebogruppe berichtet wurden 3.
Die nicht überzeugenden Ergebnisse der STAND-Studie wurden zur Grundlage für den Widerruf vonAdakveo in der EU.
-
Oxbryta Ergebnisse der klinischen Prüfung
In der HOPE-Studie wurde Oxbryta im Vergleich zu Placebo getestet. Die Wirksamkeit basierte auf den Hämoglobin (Hb)-Ansprechraten, die als Hb-Anstieg von >1 g/dL vom Ausgangswert bis Woche 24 definiert waren.
Oxbryta Patienten hatten eine Ansprechrate von 51,1 % gegenüber 6,5 % bei den Placebo-Patienten. Das indirekte Bilirubin ging bei den Patienten von Oxbryta um 29,1 % zurück, während es bei den Placebo-Patienten um 2,8 % sank. Die prozentuale Retikulozytenzahl sank bei den Patienten von Oxbryta um 18 %, während sie bei den Placebo-Patienten um 6,8 % anstieg 2.
Wie die gemeinsamen Daten zeigen, ist ein direkter Vergleich zwischen den beiden Medikamenten nicht möglich, da in den klinischen Studien unterschiedliche Wirksamkeitskriterien verwendet wurden. Da beide Behandlungen die Sichelzellkrankheit auf unterschiedliche Weise angehen, ist es wahrscheinlich, dass Oxbryta kein direkter Ersatz für Adakveo sein wird, sondern eher Teil eines neuen Behandlungsplans, den Ihr Arzt für Sie erstellt.

Adakveo vs Oxbryta: Sicherheit und Nebenwirkungen
Laut den Verschreibungsinformationen sind dies die häufigsten Nebenwirkungen von Adakveo und Oxbryta:
Adakveo Nebeneffekte
- Übelkeit
- Gelenkschmerzen
- Rückenschmerzen
- Magenschmerzen
- Fieber1.
Während der SUSTAIN-Studie traten bei 3 % der Patienten infusionsbedingte Reaktionen auf, die durch Symptome wie Kopfschmerzen, Schüttelfrost, Erbrechen, Durchfall, Kurzatmigkeit oder Keuchen gekennzeichnet waren 1.
Oxbryta Nebeneffekte
- Kopfschmerzen
- Diarrhöe
- Magenschmerzen
- Übelkeit
- Ausschlag
- Fieber 2.
Bei weniger als 1 % der Patienten in klinischen Studien traten schwerwiegende Überempfindlichkeitsreaktionen auf, darunter Hautausschlag, leichte Kurzatmigkeit, leichte Gesichtsschwellungen und Eosinophilie (Anstieg der Zahl der weißen Blutkörperchen)2.
Adakveo vs Oxbryta: Vergleich der Preise
Bei den Preisen für noch nicht zugelassene oder noch nicht verfügbare Arzneimittel handelt es sich lediglich um Richtwerte. Der Endpreis kann je nach Standort oder Anbieter variieren.
Adakveo Kosten pro Jahr
Die empfohlene Dosierung für Adakveo beträgt 5 mg/kg Körpergewicht alle 4 Wochen. Das bedeutet 13 Infusionen pro Jahr. Für eine Person, die 60 kg wiegt, würde dies 13 Infusionen x 300 mg von Adakveo oder 39 Ampullen des Arzneimittels erfordern.
Bei einem Preis von rund 5.214 EUR pro 100-mg-Ampulle belaufen sich die jährlichen Kosten für eine Behandlung auf Adakveo auf rund 203.346 EUR 5.
Oxbryta Kosten pro Jahr
Die empfohlene Dosierung von Oxbryta für Patienten mit einem Körpergewicht über 40 kg beträgt 1.500 mg Oxbryta einmal täglich, was 3 Tabletten à 500 mg entspricht.
Eine Packung mit 90 x 500 mg Tabletten kostet etwa 40.365 EUR und reicht bei der oben empfohlenen Dosierung für einen Monat. Daher belaufen sich die jährlichen Kosten für die Behandlung von Oxbryta auf 484.380 EUR 6.
Wo sind Adakveo und Oxbryta zugelassen?
Adakveo (crizanlizumab) ist derzeit in mehreren Ländern zugelassen, darunter in den USA, Kanada und Australien 7,9,10. Seine bedingte Zulassung in der EU wurde im Mai 2023 widerrufen 3.
Oxbryta (voxelotor) ist in den USA, der EU und Kanada zugelassen 4,8,9. In der EU ist Oxbryta jedoch noch nicht in großem Umfang auf dem Markt erhältlich, da die Zeit zwischen Zulassung und Markteinführung von Land zu Land sehr unterschiedlich sein kann.
Ist Adakveo oder Oxbryta in Ihrem Land nicht (mehr) zugelassen oder verfügbar? Wenn Sie und Ihr Arzt der Meinung sind, dass diese Behandlungen für Sie von Nutzen sein könnten, setzen Sie sich mit unserem Expertenteam für den Zugang zu Arzneimitteln in Verbindung. Wir können Ihnen ein individuelles Preisangebot für die Beschaffung des Medikaments unterbreiten.
Referenzen:
- HIGHLIGHTS DER VERSCHREIBUNGSINFORMATIONEN. Novartis, Zugriff am 27. September 2023.
- HIGHLIGHTS DER VERSCHREIBUNGSINFORMATIONEN. Oxbryta, Zugriff am 27. September 2023.
- Adakveo | Europäische Arzneimittel-Agentur. Europäische Arzneimittel-Agentur, Zugriff am 27. September 2023.
- Oxbryta | Europäische Arzneimittel-Agentur. Europäische Arzneimittel-Agentur, Zugriff am 27. September 2023.
- Adakveo ( crizanlizumab)online kaufen. Everyone.org Zugriff am 27. September 2023.
- Oxbryta ( voxelotor)online kaufen. Everyone.org Zugriff am 27. September 2023.
- Adakveo. Therapeutic Goods Administration (TGA), Zugriff am 27. September 2023.
- FDA genehmigt Medikament zur Behandlung der Sichelzellkrankheit bei Kindern. FDA, 17. Dezember 2021.
- 2019 neu zugelassene Medikamente - Meds Entry Watch. Kanada.ca, 10. Februar 2021.
- FDA genehmigt erste zielgerichtete Therapie zur Behandlung von Patienten mit schmerzhafter Komplikation der Sichelzellkrankheit. FDA, 15. November 2019.