Adakveo vs. Oxbryta: Die Alternativen zu crizanlizumab kennenlernen
Zuletzt aktualisiert: 15. Januar 2024
Sie können legal Zugang zu neuen Arzneimitteln erhalten, auch wenn diese in Ihrem Land nicht zugelassen sind.
Erfahren Sie, wie
Nachdem die Zulassung von Adakveo crizanlizumab) in der EU widerrufen wurde, sind viele Patienten und Ärzte auf der Suche nach einer Alternative zu Adakveo .
Wenn Sie gut auf Ihre Behandlung angesprochen haben, können Sie Adakveo weiterhin erhalten, auch wenn es in der EU nicht mehr zugelassen ist. Wenn Ihr Arzt es jedoch vorzieht, Ihre Behandlung zu ändern, ist es gut zu wissen, was dies für Sie als Patient bedeutet.
In diesem Artikel befassen wir uns mit einer der möglichen Adakveo , die Ihr Arzt vielleicht besprechen möchte - Oxbryta voxelotor). Hier finden Sie einen kurzen Überblick über die Gemeinsamkeiten und Unterschiede zwischen Adakveo und Oxbryta.
Adakveo vs. Oxbryta: Wofür werden sie verwendet?
Sowohl Adakveo als auch Oxbryta sind verschreibungspflichtige Arzneimittel für die Behandlung der Sichelzellenkrankheit 1,2. Jedes der Medikamente zielt jedoch auf einen anderen Aspekt der Krankheit ab.
Adakveo zielt darauf ab, die Häufigkeit schmerzhafter vasokonstriktiver Krisen zu verringern, während Oxbryta zur Behandlung der hämolytischen Anämie bei Sichelzellpatienten eingesetzt wird 1,2.
Für welches Alter ist Oxbryta in der EU zugelassen?
Im Gegensatz zu Adakveo, das nur bei Patienten ab 16 Jahren angewendet werden kann, ist Oxbryta auch für pädiatrische Patienten geeignet.
In den USA kann Oxbryta ab einem Alter von 4 Jahren verschrieben werden, während in der EU die pädiatrische Verwendung erst ab einem Alter von 12 Jahren zugelassen ist 1,2.
Crizanlizumab vs. Voxelotor: Wie funktionieren sie?
Beide Arzneimittel zielen darauf ab, die Komplikationen der Sichelzellkrankheit zu verringern, doch sie zielen auf unterschiedliche Aspekte der Krankheit ab.
Adakveo und die Verringerung von schmerzhaften Krisen
Adakveo zielt darauf ab, die Häufigkeit von schmerzhaften Krisen zu verringern, die auftreten, wenn missgebildete Blutzellen in Blutgefäßen stecken bleiben.
Der Wirkstoff des Medikaments, crizanlizumab, ist ein spezieller Proteintyp, ein so genannter monoklonaler Antikörper. Dieses Protein ist so formuliert, dass es an P-Selektin bindet, eine Substanz, die sich auf der äußeren Schicht der Zellen befindet, die die Blutgefäße auskleiden.
P-Selektin hilft den Zellen, an den Blutgefäßen zu haften, und ist an den Gefäßverschlüssen während der schmerzhaften Episoden der Sichelzellenkrankheit beteiligt. Indem Adakveo an P-Selektin anknüpft und seine Funktion hemmt, soll es diese schmerzhaften Episoden verhindern 3.
Oxbryta und die Prävention von Anämie
Oxbryta hingegen zielt darauf ab, die mit der Sichelzellenkrankheit verbundene Anämie zu verhindern.
Der Wirkstoff von Oxbryta, voxelotor, verbessert die Fähigkeit des Hämoglobins, Sauerstoff zu binden, und verhindert, dass es in den Blutgefäßen steife Ketten bildet. Dies trägt dazu bei, dass die roten Blutkörperchen ihre normale Form und Flexibilität behalten. Außerdem verringert es die Rate ihrer vorzeitigen Zerstörung und verlängert ihre Lebensdauer 4.
Wie effizient sind Adakveo und Oxbryta?
Die Wirksamkeit von Adakveo crizanlizumab) und Oxbryta voxelotor) wurde in klinischen Studien untersucht.
-
Ergebnisse der klinischen Studie mit Adakveo
Die FDA-Zulassung von Adakveo sowie die erste Marktzulassung in der EU basierten auf den Ergebnissen der klinischen Studie SUSTAIN. In der Studie wurde Adakveo (mit oder ohne Hydoxyharnstoff) mit Placebo verglichen.
Den Ergebnissen der SUSTAIN-Studie zufolge hatten die mit Adakveo behandelten Patienten eine statistisch signifikant niedrigere mittlere jährliche Rate an vasookklusiven Krisen (VOCs) - 1,63 gegenüber 2,98 bei Placebo-Patienten. 36 % der Adakveo in der Studie hatten während des 52-wöchigen Studienzeitraums keine VOCs, gegenüber 17 % der Placebo-Patienten 1.
Was waren die Ergebnisse der Adakveo STAND-Studie?
In der globalen Phase-3-Studie STAND, in der Adakveo erneut mit Placebo verglichen wurde, konnte kein statistisch signifikanter Unterschied in der Rate der VOCs zwischen den Patientengruppen nachgewiesen werden. Bei den mit Adakveo behandelten Patienten traten innerhalb eines Jahres durchschnittlich 2,5 schmerzhafte Krisen auf - kein signifikanter Unterschied zu den durchschnittlich 2,3 Krisen, die in der Placebogruppe berichtet wurden 3.
Die nicht überzeugenden Ergebnisse der STAND-Studie waren die Grundlage für den Widerruf vonAdakveo in der EU.
-
Ergebnisse klinischer Studien mit Oxbryta
In der HOPE-Studie wurde Oxbryta im Vergleich zu Placebo getestet. Die Wirksamkeit basierte auf den Ansprechraten des Hämoglobins (Hb), definiert als ein Hb-Anstieg von >1 g/dL vom Ausgangswert bis Woche 24.
Oxbryta hatten eine Ansprechrate von 51,1 % gegenüber 6,5 % bei den Placebo-Patienten. Das indirekte Bilirubin sank bei den Oxbryta um 29,1 %, während es bei den Placebo-Patienten um 2,8 % zurückging. Die prozentuale Retikulozytenzahl sank bei den Oxbryta um 18 %, während sie bei den Placebo-Patienten um 6,8 % anstieg. 2.
Wie die gemeinsamen Daten zeigen, ist ein direkter Vergleich zwischen den beiden Medikamenten nicht möglich, da in den klinischen Studien unterschiedliche Wirksamkeitskriterien angewandt wurden. Da beide Behandlungen die Sichelzellkrankheit auf unterschiedliche Weise angehen, ist es wahrscheinlich, dass Oxbryta kein direkter Ersatz für Adakveo sein wird, sondern eher Teil eines neuen Behandlungsplans, den Ihr Arzt für Sie erstellen wird.
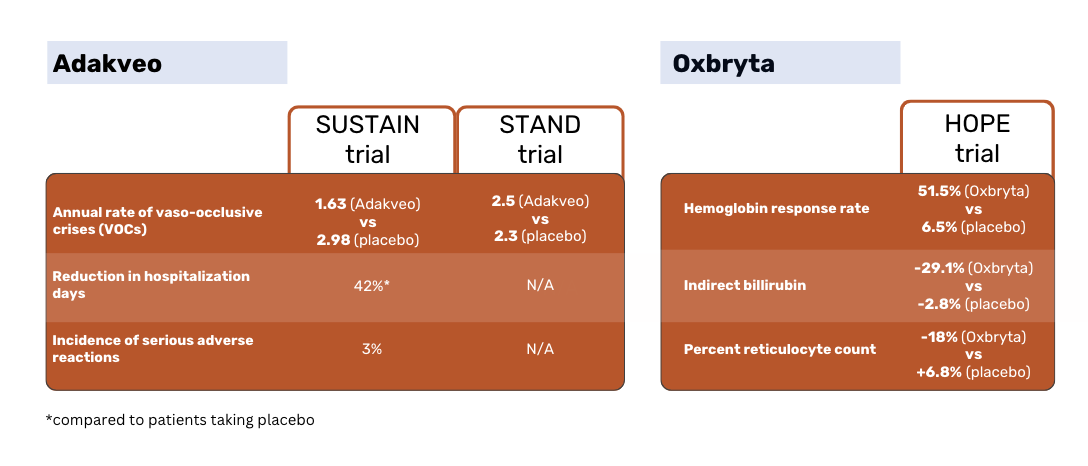

Adakveo vs. Oxbryta: Sicherheit und Nebenwirkungen
Laut den Verschreibungsinformationen sind dies die häufigsten Nebenwirkungen von Adakveo und Oxbryta:
Adakveo
- Übelkeit
- Gelenkschmerzen
- Rückenschmerzen
- Magenschmerzen
- Fieber1.
Während der SUSTAIN-Studie traten bei 3 % der Patienten infusionsbedingte Reaktionen auf, die durch Symptome wie Kopfschmerzen, Schüttelfrost, Erbrechen, Durchfall, Kurzatmigkeit oder Keuchen gekennzeichnet waren 1.
Oxbryta
- Kopfschmerzen
- Diarrhöe
- Magenschmerzen
- Übelkeit
- Ausschlag
- Fieber 2.
Bei weniger als 1 % der Patienten in klinischen Studien traten schwerwiegende Überempfindlichkeitsreaktionen auf, darunter Hautausschlag, leichte Kurzatmigkeit, leichte Gesichtsschwellungen und Eosinophilie (Anstieg der Zahl der weißen Blutkörperchen)2.
Adakveo vs. Oxbryta: Vergleich der Preise
Bei den Preisen für noch nicht zugelassene oder noch nicht verfügbare Arzneimittel handelt es sich lediglich um Richtwerte. Der Endpreis kann je nach Standort oder Anbieter variieren.
Adakveo Kosten pro Jahr
Die empfohlene Dosis für Adakveo beträgt 5 mg/kg Körpergewicht alle 4 Wochen. Das bedeutet 13 Infusionen pro Jahr. Für eine Person, die 60 kg wiegt, würde dies 13 Infusionen x 300 mg Adakveo oder 39 Ampullen des Arzneimittels erfordern.
Bei einem Preis von rund 5.214 EUR pro 100-mg-Ampulle belaufen sich die jährlichen Kosten für eine Adakveo auf rund 203.346 EUR 5.
Oxbryta Kosten pro Jahr
Die empfohlene Dosierung von Oxbryta für Patienten mit einem Körpergewicht von mehr als 40 kg beträgt 1.500 mg Oxbryta einmal täglich, entsprechend 3 Tabletten zu je 500 mg.
Eine Packung mit 90 x 500 mg Tabletten kostet etwa 40.365 EUR und reicht bei der oben empfohlenen Dosierung für einen Monat. Daher belaufen sich die jährlichen Kosten für die Behandlung mit Oxbryta auf 484.380 EUR 6.
Wo sind Adakveo und Oxbryta zugelassen?
Adakveo crizanlizumab) ist derzeit in mehreren Ländern zugelassen, darunter in den USA, Kanada und Australien 7,9,10. Seine bedingte Zulassung in der EU wurde im Mai 2023 widerrufen 3.
Oxbryta voxelotor) ist in den USA, der EU und Kanada zugelassen 4,8,9. In der EU ist Oxbryta jedoch noch nicht in großem Umfang auf dem Markt erhältlich, da die Zeit zwischen Zulassung und Markteinführung von Land zu Land sehr unterschiedlich sein kann.
Ist Adakveo oder Oxbryta in Ihrem Land nicht (mehr) zugelassen oder verfügbar? Wenn Sie und Ihr Arzt der Meinung sind, dass diese Behandlungen für Sie von Nutzen sein könnten, wenden Sie sich an unser Expertenteam für den Zugang zu Arzneimitteln. Wir können Ihnen ein individuelles Preisangebot für die Beschaffung des Medikaments unterbreiten.
Referenzen:
- HIGHLIGHTS DER VERSCHREIBUNGSINFORMATIONEN. Novartis, Zugriff am 27. September 2023.
- HIGHLIGHTS DER VERSCHREIBUNGSINFORMATIONEN. Oxbryta, abgerufen am 27. September 2023.
- Adakveo | Europäische Arzneimittel-Agentur. Europäische Arzneimittel-Agentur, Zugriff am 27. September 2023.
- Oxbryta | Europäische Arzneimittelbehörde. Europäische Arzneimittel-Agentur, Zugriff am 27. September 2023.
- Adakveo (crizanlizumab) online kaufen. Everyone.org, Zugriff am 27. September 2023.
- Oxbryta (voxelotor) online kaufen. Everyone.org, Zugriff am 27. September 2023.
- Adakveo. Therapeutic Goods Administration (TGA), Zugriff am 27. September 2023.
- FDA genehmigt Medikament zur Behandlung der Sichelzellenkrankheit bei Kindern. FDA, 17. Dezember 2021.
- 2019 neu zugelassene Medikamente - Meds Entry Watch. Kanada.ca, 10. Februar 2021.
- FDA genehmigt erste zielgerichtete Therapie zur Behandlung von Patienten mit schmerzhafter Komplikation der Sichelzellkrankheit. FDA, 15. November 2019.