Was ist der Unterschied zwischen Leqembi und Aduhelm? Ein einfacher Überblick.
Zuletzt aktualisiert: 19. November 2024
Sie können legal Zugang zu neuen Arzneimitteln erhalten, auch wenn diese in Ihrem Land nicht zugelassen sind.
Erfahren Sie, wieSeit 2021 hat die FDA zwei neuen Alzheimer-Medikamenten eine beschleunigte Zulassung erteilt. Bei diesen Medikamenten handelt es sich um die Anti-Amyloid-Therapien Leqembi (Lecanemab) und Aduhelm (Aducanumab). Beide Zulassungen erfolgten nach fast 20 Jahren ohne größere Durchbrüche bei der Behandlung der Alzheimer-Krankheit. Aus diesem Grund haben beide Medikamente große Aufmerksamkeit in den Medien erhalten.
Die Resonanz war jedoch gemischt. Maria Carrillo, Chief Science Officer der Alzheimer's Association, bezeichnete die Zulassung der neuen Medikamente als "einen Meilenstein für Menschen, die für diese Behandlung in Frage kommen" [2]. Gleichzeitig war das Zulassungsverfahren von Kontroversen begleitet, insbesondere im Fall von Aduhelm [1, 4].
Als Patient fragen Sie sich wahrscheinlich, was der Unterschied zwischen Leqembi (Lecanemab) und Aduhelm (Aducanumab) ist. In diesem Artikel vergleichen wir die beiden Medikamente hinsichtlich ihrer Wirkungsweise, ihrer Wirksamkeit sowie ihrer Kosten und Verfügbarkeit.
Leqembi gegen Aduhelm: Wofür werden sie verwendet?
Beide Medikamente sind zur Behandlung der frühen Alzheimer-Krankheit geeignet. Sie sind Anti-Amyloid-Therapien und richten sich gegen Amyloid-Plaques im Gehirn.
Laut den Verschreibungsinformationen sind Leqembi und Aduhelm für Patienten mit leichter kognitiver Beeinträchtigung und nachweislich erhöhten Beta-Amyloid-Werten bestimmt [5].
Leqembi vs. Aduhelm: Wie funktionieren sie?
Ähnlichkeiten
Leqembi (Lecanemab) und Aduhelm (Aducanumab) sind beides monoklonale Antikörper. Sie zielen auf die Beta-Amyloid-Plaques ab, die sich im Gehirn von Alzheimer-Patienten bilden. Es wird vermutet, dass diese Ablagerungen zum kognitiven und klinischen Verfall bei dieser Krankheit beitragen.
Beide Medikamente binden an Amyloid-Plaques und neutralisieren sie, um das Fortschreiten der Krankheit zu verlangsamen. Dadurch unterscheiden sich Leqembi und Aduhelm grundlegend von bisherigen Alzheimer-Behandlungen wie Galantamin, Rivastigmin und Donepezil. Diese bisherigen Behandlungen konzentrieren sich darauf, die Symptome der Krankheit zu lindern. Leqembi und Aduhelm zielen darauf ab, den Krankheitsverlauf zu verändern, indem sie die Ursache der Krankheit bekämpfen.
Unterschiede
Leqembi und Aduhelm binden an unterschiedliche Teile des Beta-Amyloid-Proteins. Aduhelm bindet stärker an größere, verhärtete Amyloid-Plaques. Leqembi wirkt Berichten zufolge besser auf die kleinere, lösliche (und giftigere) Form des Amyloid-Proteins [6].
Wie effizient sind Leqembi und Aduhelm?
Die Wirksamkeit von Leqembi (Lecanemab) und Aduhelm(Aducanumab) wurde in klinischen Studien untersucht.
-
Ergebnisse der klinischen Studie mit Leqembi
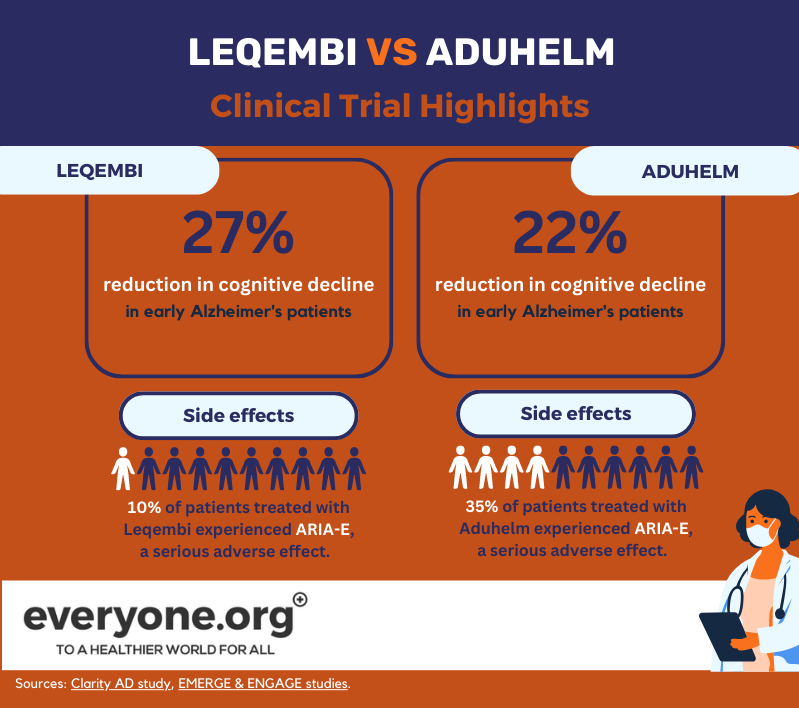
Die beschleunigte FDA-Zulassung von Leqembi beruhte auf den positiven Ergebnissen der Phase-3-Studie Clarity AD. Diesen Ergebnissen zufolge verlangsamte Lecanemab den kognitiven Abbau bei Alzheimer-Patienten im Frühstadium um bis zu 27 % im Vergleich zu Placebo. Diese Ergebnisse wurden 18 Monate nach Beginn der Behandlung gemessen [8].
Eine zusätzliche Analyse der Studienergebnisse wurde im April 2023 veröffentlicht. Sie zeigte, dass die Patienten auch nach dem Absetzen von Leqembi über einen Zeitraum von 9 bis 59 Monaten weiterhin von einer Verzögerung des kognitiven Abbaus profitierten. Während dieser "Lückenzeit" schien die Alzheimer-Krankheit bei Patienten, die in der ursprünglichen klinischen Studie Leqembi erhielten, durchweg langsamer voranzuschreiten als bei Patienten, die ein Placebo erhielten [7].
Die schwerwiegende unerwünschte Wirkung von ARIA-E trat bei 10 % der mit Leqembi behandelten Patienten auf. Bei 6 % der Patienten in der Studie trat ARIA-H, eine weitere schwerwiegende unerwünschte Wirkung, auf [13].
-
Ergebnisse der klinischen Studie mit Aduhelm
Die FDA erteilte ihre beschleunigte Zulassung für Aduhelm auf der Grundlage von zwei klinischen Phase-3-Studien. Eine davon (EMERGE) zeigte eine Verringerung des klinischen Rückgangs der Patienten um bis zu 22 % [12]. In der anderen (ENGAGE) war dies nicht der Fall. In beiden Studien zeigte Aduhelm jedoch eine Verringerung der Amyloid-Plaques im Gehirn [9]. Die FDA entschied, dass diese Indikation "mit hinreichender Wahrscheinlichkeit zu einem klinischen Nutzen führen wird" [10].
Eine Bestätigungsstudie der Phase 4 (ENVISION) begann im Juni 2022, wie von der FDA gefordert. Die Ergebnisse werden für 2026 erwartet [9].
Laut der Verschreibungsinformation von Aduhelm traten bei 35 % der Patienten, die das Medikament in klinischen Studien erhielten, ARIA-E auf. Bei 34 % der Studienpatienten trat ARIA-H auf [15].
Wie diese aktuellen Daten zeigen, scheint der Hauptunterschied zwischen Leqembi und Aduhelm derzeit in ihrem Sicherheitsprofil zu liegen, wobei Leqembi eine geringere Inzidenz unerwünschter Wirkungen aufweist.
Gleichzeitig scheint Leqembi, basierend auf den aktuellen Daten aus klinischen Studien, eine beständigere Wirkung auf den kognitiven Verfall zu haben. Die Ergebnisse der laufenden Studien sowohl zu Leqembi als auch zu Aduhelm werden mehr Klarheit über die Leistung beider Medikamente bringen.
HINWEIS: Die hier mitgeteilten Ergebnisse dienen der Information und sollten nicht als Grundlage für eine Behandlungsentscheidung verwendet werden. Ihr Arzt ist am besten in der Lage, die für Ihren Fall am besten geeignete Behandlung zu bestimmen.

Leqembi vs. Aduhelm: Sicherheit und Nebenwirkungen
Laut den Verschreibungsinformationen sind dies die häufigsten Nebenwirkungen von Leqembi (Lecanemab) und Aduhelm:
Leqembi-Nebenwirkungen
- infusionsbedingte Reaktionen, einschließlich Fieber, grippeähnliche Symptome, Übelkeit, Veränderungen der Herzfrequenz und Kurzatmigkeit;
- Kopfschmerzen;
- Amyloid-bedingte Bildgebungsanomalien (ARIA) [13]. Bei ARIA kann es zu vorübergehenden Schwellungen oder Blutungen im Gehirn kommen. Symptome von ARIA sind Kopfschmerzen, Verwirrung, Krampfanfälle, Schwierigkeiten beim Gehen und Schwindel. Träger des homozygoten Apolipoprotein-E-Gens können ein höheres Risiko für ARIA haben [14].
Aduhelm
Die häufigsten Nebenwirkungen von Aduhelm sind ARIA, Kopfschmerzen und Sturz. Eine für Aduhelm , nicht aber für Leqembi angegebene Nebenwirkung ist eine Überempfindlichkeitsreaktion. Zu den Überempfindlichkeitsreaktionen können Angioödeme (Schwellung der tieferen Hautschichten) und Urtikaria (Hautausschlag) gehören [15].
Leqembi vs. Aduhelm: Vergleich der Preise
Bei Arzneimitteln, die noch nicht weithin verfügbar sind, sollten Sie jeden Preis nur als Anhaltspunkt betrachten. Die endgültigen Kosten können je nach Standort, Anbieter oder Versicherungsschutz variieren.
Eine Einzeldosis von Leqembi kostet etwa 1.043 EUR. Bei der empfohlenen zweiwöchentlichen Verabreichung des Medikaments belaufen sich die jährlichen Kosten für eine Person auf etwa 27.118 EUR [16].
Der Richtpreis für Aduhelm pro Einzeldosis-Fläschchen beträgt 1.335 EUR. Umgerechnet auf die jährlichen Kosten für eine Person sind das 34.710 EUR [17].
Wo sind Leqembi und Aduhelm zugelassen?
Leqembi (Lecanemab) ist derzeit nur in den USA und im Vereinigten Königreich zugelassen, die EMA-Zulassung wird für Ende 2024 erwartet[3]. Leqembi hat auch Anträge auf Marktzulassung in China und Japan eingereicht [18, 19, 20].
Aduhelm (Aducanumab) wurde im Juni 2021 von der FDA in den USA im beschleunigten Verfahren zugelassen. Die Europäische Arzneimittelagentur (EMA) lehnte den Zulassungsantrag für Aduhelm im Dezember 2021 ab. Der Antrag wurde daraufhin im April 2022 von Biogen zurückgezogen [21]. Auch das japanische Gesundheitsministerium hat ein negatives Signal bezüglich der Zulassung von Aduhelm in seinem Land gesendet [22].
Ist Leqembi oder Aduhelm in Ihrem Land (noch) nicht zugelassen oder verfügbar? Wenn Sie und Ihr Arzt der Meinung sind, dass diese Behandlungen für Sie von Nutzen sein könnten, wenden Sie sich an unser Expertenteam für medizinischen Zugang. Wir können Ihnen ein individuelles Preisangebot für die Beschaffung des Medikaments unterbreiten.
Referenzen:
- Der monoklonale Anti-Amyloid-Antikörper Lecanemab: 16 Vorsichtshinweise. Zenodo, 3. Januar 2023.
- Hamilton, Jon. FDA erteilt Alzheimer-Medikament Leqembi beschleunigte Zulassung : Shots - Health News. NPR, 6. Januar 2023.
- FDA-Beratungsausschuss bestätigt einstimmig den klinischen Nutzen von LEQEMBI® (Lecanemab-irmb) zur Behandlung der Alzheimer-Krankheit. Biogen | Investor Relations, 9. Juni 2023.
- Helmore, Edward. FDA unter Beschuss wegen der Zulassung des Alzheimermittels Aduhelm. The Guardian, 29. Dezember 2022.
- HIGHLIGHTS DER VERSCHREIBUNGSINFORMATIONEN. Leqembi, Zugriff am 3. August 2023.
- Taylor, Emma. Neue Alzheimer-Behandlung, Lecanemab, macht Schlagzeilen: Was kommt als nächstes? Alzheimer's Research UK, 13. Dezember 2022.
- Eisai: Alzheimer-Patienten profitieren von Leqembi, auch wenn es abgesetzt wird. CNBC, 6. April 2023.
- Leqembi | ALZFORUM. Alzforum, 30. Mai 2023, Zugriff am 3. August 2023.
- Aduhelm | ALZFORUM. Alzforum, 6. Februar 2023, Zugriff am 3. August 2023.
- Cavazzoni, Patrizia. FDA-Entscheidung zur Zulassung einer neuen Behandlung für die Alzheimer-Krankheit. FDA, 7. Juni 2021.
- Eisai präsentiert vollständige Ergebnisse der Phase-III-Studie Clarity AD mit Lecanemab. Alzheimer Europa, 30. November 2022.
- EMERGE- und ENGAGE-Topline-Ergebnisse: Zwei Phase-3-Studien zur Untersuchung von Aducanumab bei Patienten mit früher Alzheimer-Krankheit. Biogen | Investor Relations, abgerufen am 3. August 2023.
- Referenz-ID: 5105416. Accessdata.fda.gov, abgerufen am 3. August 2023.
- MEDIZINLEITFADEN LEQEMBI® (leh-kem'-bee) (lecanemab-irmb) Injektion, zur intravenösen Anwendung. Leqembi, Zugriff am 3. August 2023.
- HIGHLIGHTS DER VERSCHREIBUNGSINFORMATIONEN. Accessdata.fda.gov, abgerufen am 3. August 2023.
- Leqembi (lecanemab-irmb) online kaufen - Preis und Kosten. Everyone.org, Zugriff am 3. August 2023.
- Aduhelm (aducanumab-avwa) online kaufen - Preis und Kosten. Everyone.org, Zugriff am 3. August 2023.
- EISAI reicht Antrag auf Marktzulassung von LECANEMAB zur Behandlung der frühen ALZHEIMER-Krankheit in Europa ein | Biogen. Biogen | Investor Relations, 10. Januar 2023.
- Eisai leitet BLA-Einreichung von Daten für Lecanemab in China ein | Biogen. Biogen | Investor Relations, 22. Dezember 2022.
- Carvalho, Teresa, und Ray Burow. Lecanemab für Alzheimer im Frühstadium steht in Japan zur Prüfung an. Alzheimer's News Today, 14. März 2022.
- Update zum Zulassungsantrag für Aducanumab in der Europäischen Union | Biogen. Biogen | Investor Relations, 22. April 2022.
- Swift, Rocky, et al. Eisai-Biogen Alzheimer-Medikament schwer zu beurteilen - japanisches Ministerium. Reuters, 22. Dezember 2021.