Neue Therapien für Neurofibromatose: Was zur Verfügung steht und wie man sie im Vereinigten Königreich erhält
Zuletzt aktualisiert: 11. März 2025
Sie können legal Zugang zu neuen Arzneimitteln erhalten, auch wenn diese in Ihrem Land nicht zugelassen sind.
Erfahren Sie, wieNeurofibromatose Typ 1 (NF1) ist eine komplexe genetische Störung, von der weltweit etwa einer von 3.000 Menschen betroffen ist. Im Vereinigten Königreich leben etwa 25.000 Menschen mit dieser Krankheit.
NF1 führt häufig zur Entwicklung von plexiformen Neurofibromen (pNF) - Tumoren, die Schmerzen, Entstellungen und schwere Komplikationen verursachen können. Bis vor kurzem beschränkten sich die Behandlungsmöglichkeiten auf Operationen und Symptomkontrolle.
In den letzten Jahren haben neue zielgerichtete Therapien eine bessere Kontrolle der Krankheit und eine bessere Lebensqualität ermöglicht. Die erste Innovation war Koselugo (selumetinib), der erste von der FDA zugelassene MEK-Inhibitor für NF1-bedingte pNFs. Im Februar 2025 erteilte die FDA auch die Zulassung für Gomekli (Mirdametinib) und setzte damit einen weiteren wichtigen Meilenstein in der NF1-Behandlung.
Wenn Sie im Vereinigten Königreich leben und sich fragen, wann und wie Sie Zugang zu diesen neuen Behandlungen für NF1 erhalten können, sollten Sie Folgendes wissen.
Was sind die neuesten Behandlungsmethoden für NF1?
Die beiden jüngsten NF1-Medikamente, die von der FDA zugelassen wurden, sind beides MEK-Inhibitoren. Das bedeutet, dass sie Enzyme (MEK1/2) blockieren, die an der Zellwachstumssignalisierung beteiligt sind. MEK1/2 sind bei Patienten mit NF1 überaktiv, was zum Wachstum der Tumorzellen beiträgt. Durch die Blockierung der MEK-Enzyme zielen diese neuen Neurofibromatose-Behandlungen darauf ab, das Wachstum der Tumorzellen zu verlangsamen 1.
Gomekli (Mirdametinib): Das neueste NF1-Medikament im Jahr 2025
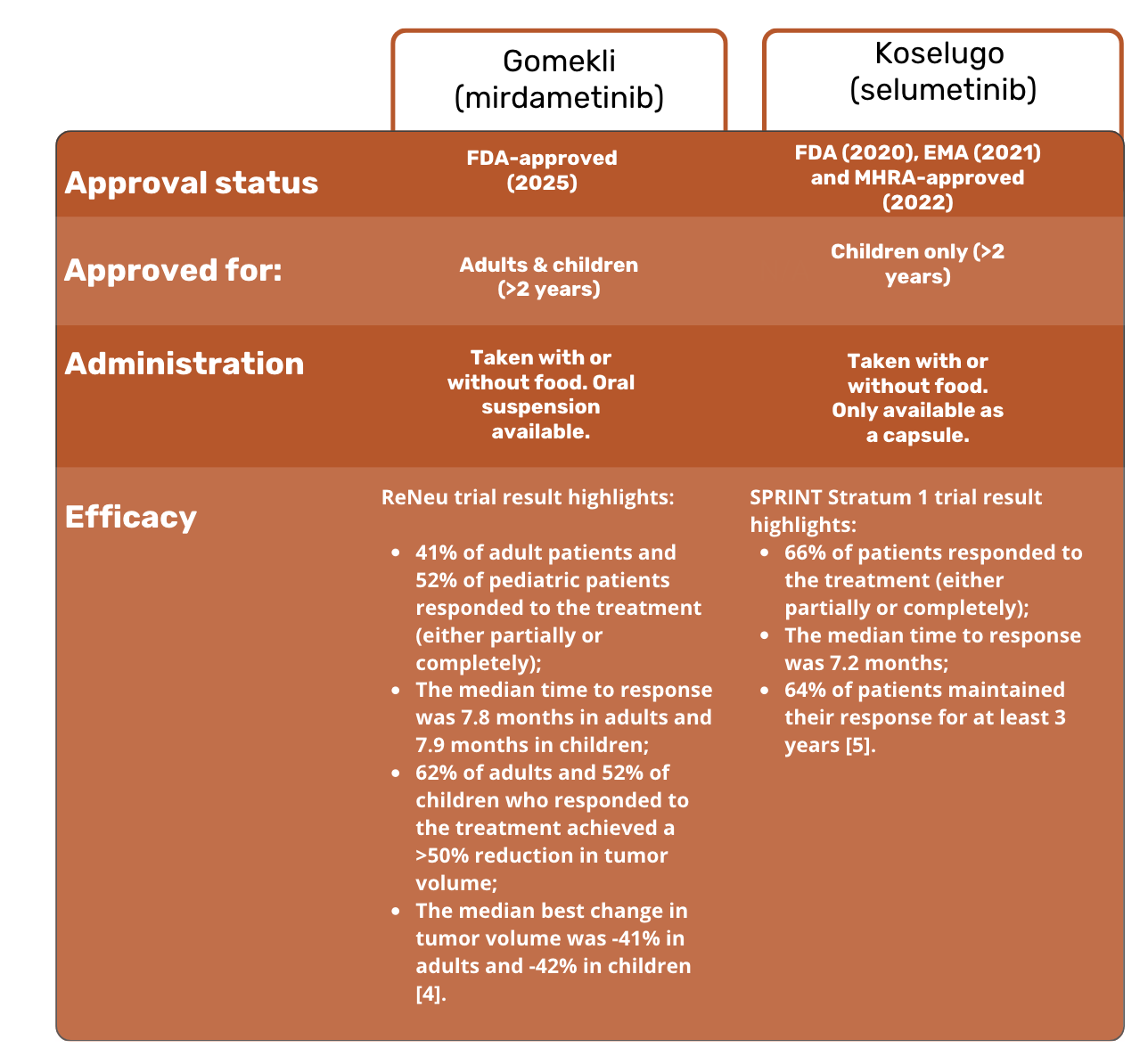
Gomekli (Mirdametinib) ist ein MEK1/2-Inhibitor, der auf den MAPK/ERK-Signalweg abzielt. Gomekli wurde im Februar 2025 von der FDA zugelassen und unterscheidet sich unter anderem in folgenden Punkten von bestehenden Behandlungen:
- Orale Verabreichung. Gomekli kann mit oder ohne Nahrung eingenommen werden und ist sowohl in Kapselform als auch als Tablette zur oralen Suspension erhältlich - dies ist besonders für Kinder geeignet, die keine Kapseln schlucken können.
- Zugelassen sowohl für Erwachsene als auch für Kinder. Gomekli ist nicht nur für die Anwendung bei erwachsenen Patienten, sondern auch bei Kindern ab 2 Jahren indiziert.
- Gute Wirksamkeit in klinischen Studien nachgewiesen. In der ReNeu-Studie der Phase 2 zeigte Gomekli positive Ergebnisse: 62 % der Erwachsenen und 52 % der Kinder erreichten eine Verringerung der Tumorgröße um mehr als 50 % 2.
Koselugo selumetinib): Ein MEK-Inhibitor für pädiatrische NF1-Patienten
Koselugo war die erste zielgerichtete Therapie, die im Jahr 2020 für NF1 zugelassen wurde. Bislang ist es nur für Kinder ab 2 Jahren zugelassen. Einige kürzlich veröffentlichte Ergebnisse der Phase-3-Studie KOMET deuten darauf hin, dass Koselugo auch für Erwachsene mit Neurofibromatose Typ 1 eine wirksame Behandlungsoption sein könnte 3. Im März 2025 ist es jedoch noch nicht für diese Zielgruppe zugelassen.
Seit 2021 ist selumetinib auch in der EU und seit 2022 auch im Vereinigten Königreich zugelassen.
Hier ist ein kurzer Vergleich von Gomekli und Koselugo:

Sind Gomekli und Koselugo im Vereinigten Königreich erhältlich?
Koselugo selumetinib) steht den Patienten im Vereinigten Königreich zur Verfügung und ist im NHS 6 enthalten.
Gomekli hingegen ist im Vereinigten Königreich noch nicht erhältlich, und auch in der EU ist es weder zugelassen noch verfügbar. Ein typisches EMA-Zulassungsverfahren dauert bis zu 210 Tage nach Einreichung des Antrags, und im Fall von Gomekli wurde noch kein Antrag eingereicht. Das bedeutet, dass es Jahre dauern könnte, bis NF1-Patienten in der EU und im Vereinigten Königreich Zugang zu diesem Medikament haben.
Kann man Gomekli im Vereinigten Königreich bekommen, bevor es lokal zugelassen ist?
Ja, das können Sie. Obwohl die EMA- und MHRA-Zulassungen für Mirdametinib nicht gerade um die Ecke liegen, haben Patienten im Vereinigten Königreich (und anderswo) die Möglichkeit, Gomekli zu erhalten, bevor es offiziell verfügbar ist. Eine Möglichkeit ist die Teilnahme an einer klinischen Studie. Eine andere Möglichkeit ist, Gomekli für den persönlichen Gebrauch aus dem Ausland zu beziehen.
Die einzelnen Optionen funktionieren wie folgt.
Teilnahme an einer klinischen Studie
Um schnell Zugang zur neuesten Neurofibromatose-Behandlung zu erhalten, können Sie versuchen, an einer laufenden klinischen Studie teilzunehmen. Dazu müssen Sie die Zulassungskriterien erfüllen. Außerdem brauchen Sie die Unterstützung Ihres behandelnden Arztes. Denken Sie daran, dass eine Studie keine Garantie dafür ist, dass Sie der Behandlungsgruppe zugewiesen werden. Es kann sein, dass Sie stattdessen ein Placebo erhalten.
Hier sind einige gute Anlaufstellen für die Suche nach laufenden klinischen Studien:
- ClinicalTrials.gov: Dies ist eine Datenbank mit allen klinischen Studien in den USA. Einige der Studien sind jedoch auch für internationale Teilnehmer offen. Zurzeit werden für diese Mirdametinib-Studien weltweit Patienten rekrutiert. Es kann sich lohnen, sie im Auge zu behalten.
- EUClinicaltrials.eu: Diese Datenbank enthält alle klinischen Prüfungen in der Europäischen Union. Derzeit enthält sie nur begrenzte Informationen über Studien, die vor dem 31. Januar 2022 begonnen wurden. Für diese Studien können Sie auf das EU-Register für klinische Studien zurückgreifen.
- myTomorrows: Diese Organisation unterstützt Patienten bei der Suche nach Behandlungsmöglichkeiten in klinischen Studien.
- Findmecure: Eine Plattform, die es Patienten ermöglicht, weltweit klinische Studien zu finden und daran teilzunehmen.
Holen Sie sich Gomekli für den persönlichen Gebrauch
Wenn eine klinische Prüfung für Sie nicht in Frage kommt, können Sie Gomekli möglicherweise für den persönlichen Gebrauch aus dem Ausland einführen. Dies ist nach der Verordnung über die Einfuhr von Arzneimitteln für namentlich genannte Patienten zulässig.
Wie es funktioniert:
- Wenn Gomekli in einem anderen Land (z. B. in den USA) vor dem Vereinigten Königreich zugelassen ist, können Sie es legal kaufen und einführen.
- Sie benötigen ein Rezept Ihres Arztes, das bestätigt, dass keine geeigneten Alternativen vor Ort verfügbar sind.
Brauchen Sie Hilfe? Unser Expertenteam für den Zugang zu Arzneimitteln bei Everyone.org ist darauf spezialisiert, Patienten den Zugang zu neuen Medikamenten zu ermöglichen, bevor diese lokal zugelassen sind. Nehmen Sie Kontakt mit uns auf und wir unterstützen Sie gerne bei der Beschaffung von Gomekli in Großbritannien.
Referenzen:
- Koselugo | Europäische Arzneimittelagentur (EMA). Europäische Arzneimittel-Agentur, abgerufen am 11. März 2025.
- Mirdametinib erhält von der FDA eine vorrangige Prüfung bei Neurofibromatose Typ 1 mit PN. Zielgerichtete Onkologie, 28. August 2024.
- Koselugo zeigte in der globalen Phase-III-Studie KOMET eine statistisch signifikante und klinisch bedeutsame objektive Ansprechrate im Vergleich zu Placebo bei Erwachsenen mit Neurofibromatose Typ 1. AstraZeneca, 12. November 2024.
- SpringWorks Therapeutics kündigt Daten an, die auf der Jahrestagung 2024 der American Society of Clinical Oncology (ASCO) präsentiert werden. SpringWorks Therapeutics, 23. Mai 2024.
- Koselugo® (selumetinib) | Wirksamkeit. Koselugo HCP, abgerufen am 11. März 2025.
- Selumetinib zur Behandlung von symptomatischen und inoperablen plexiformen Neurofibromen im Zusammenhang mit Neurofibromatose Typ 1 bei Kindern ab 3 Jahren. NICE, abgerufen am 11. März 2025.