Enhertu gegen Lungenkrebs: Wo ist es zugelassen und wie bekommt man es?
Zuletzt aktualisiert: 15. Juli 2024
Sie können legal Zugang zu neuen Arzneimitteln erhalten, auch wenn diese in Ihrem Land nicht zugelassen sind.
Erfahren Sie, wieEnhertu (fam-trastuzumab deruxtecan-nxki) ist seit seiner ersten Zulassung durch die FDA im Jahr 2019 1 eine der wichtigsten Krebsbehandlungen.
Während die Sicherheit und Wirksamkeit von Enhertu bei Eierstockkrebs und Darmkrebs noch untersucht werden, ist das Medikament bereits für mehrere Indikationen zugelassen. Dazu gehören HER2-positiver Brustkrebs, HER2-positiver Magenkrebs und HER2-armer Brustkrebs. Die FDA hat Enhertu auch für nicht-kleinzelligen Lungenkrebs mit HER2-Mutation zugelassen. Der europäische Ausschuss für Humanarzneimittel (CHMP) hat vor kurzem eine positive Stellungnahme abgegeben, um dasselbe in der EU 2 zu tun.
Wenn Sie ein Lungenkrebspatient im Vereinigten Königreich oder anderswo außerhalb der USA und der EU sind, fragen Sie sich wahrscheinlich, wann Enhertu auch für Sie verfügbar sein wird.
Hier finden Sie alles Wissenswerte über Enhertu zur Behandlung von Lungenkrebs und was Patienten im Vereinigten Königreich und im Rest der Welt erwarten können.
Was ist die Indikation für Enhertu bei Lungenkrebs?
Als zielgerichtete Therapie ist Enhertu nur für die Behandlung von Krebserkrankungen mit einer HER2-Mutation vorgesehen. Daher kommt die Behandlung bei etwa 2 % aller NSCLC-Patienten zum Einsatz 3.
Enhertu ist als Monotherapie bei erwachsenen Patienten mit fortgeschrittenem nicht-kleinzelligem Lungenkrebs (NSCLC) indiziert, deren Tumoren eine aktivierende HER2-Mutation (ERBB2) aufweisen. Enhertu richtet sich an Patienten, die zuvor eine systemische Therapie erhalten haben und deren Krebs entweder auf andere Körperteile übergegriffen hat oder nicht chirurgisch entfernt werden kann 2.
Wie hoch ist die Erfolgsquote von Enhertu bei Lungenkrebs?
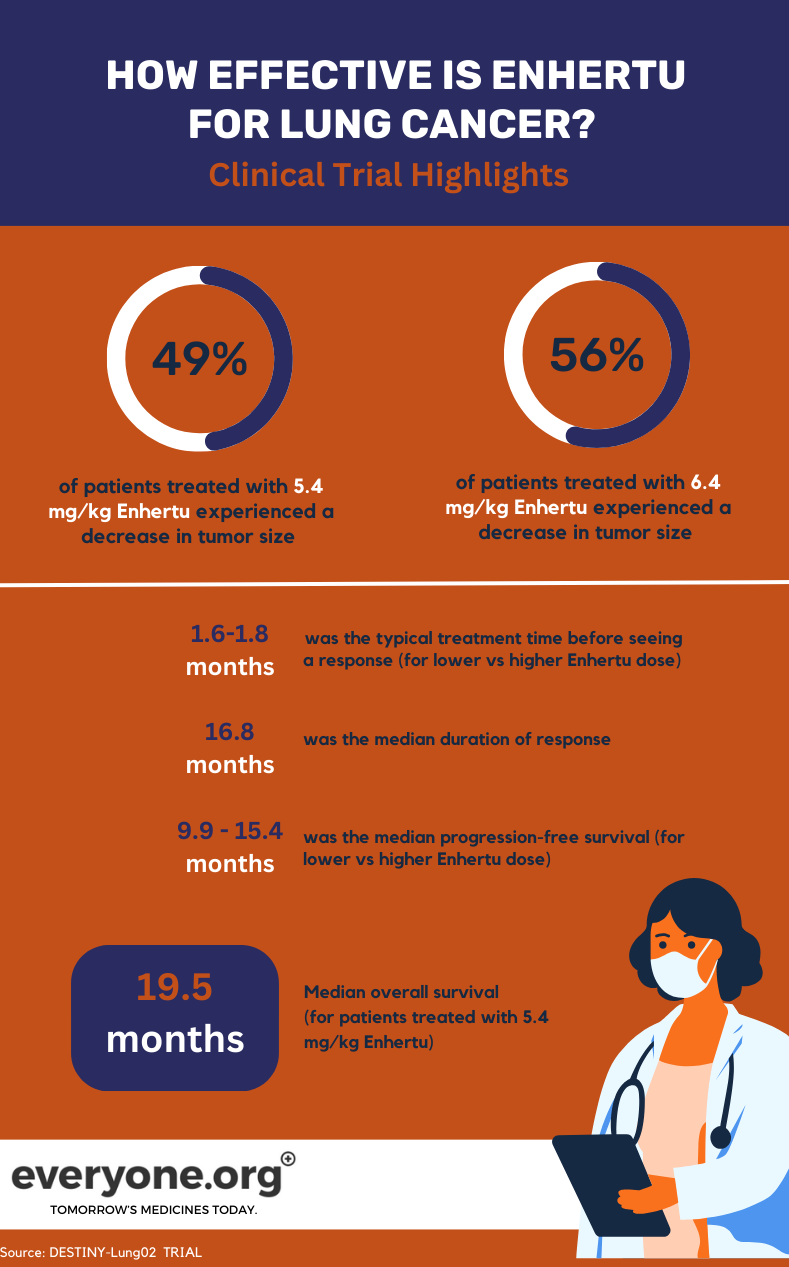
In der laufenden Phase-II-Studie DESTINY-Lung02 wird die Sicherheit und Wirksamkeit von Enhertu bei der Behandlung von HER2-mutiertem NSCLC untersucht. In der Studie werden zwei Dosierungen von Enhertu (5,4 mg/kg und 6,4 mg/kg) verglichen.
Die wichtigsten vorläufigen Ergebnisse der DESTINY-Lung02-Studie für Lungenkrebspatienten sind:
- Die Tumore schrumpften bei 49 % der Patienten, die mit der niedrigeren Enhertu Dosis behandelt wurden, und bei 56 % der Patienten, die mit der höheren Dosis behandelt wurden.
- Bei 1 % der Patienten in der niedrigeren und 4 % in der höheren Dosisgruppe verschwanden die Tumore vollständig.
- Die mediane Dauer des Ansprechens betrug 16,8 Monate bei den Patienten in der Gruppe mit der niedrigeren Enhertu Dosis. Für die Patienten in der anderen Gruppe wurde die Dauer des Ansprechens als nicht abschätzbar angegeben.
- Die mediane Zeit bis zum ersten Ansprechen auf die Behandlung betrug 1,8 Monate in der Gruppe mit der niedrigeren und 1,6 Monate in der Gruppe mit der höheren Dosis.
- Das mediane progressionsfreie Überleben betrug 9,9 Monate bei 5,4 mg/kg und 15,4 Monate bei 6,4 mg/kg 4.
Wie hoch war die mediane Überlebenszeit der Patienten von Enhertu ?
Bei den Patienten, die in der klinischen Studie die niedrigere Dosis Enhertu erhielten, betrug das mediane Gesamtüberleben (OS) 19,5 Monate. Für die Gruppe mit der höheren Dosis 4 wurde das OS als nicht abschätzbar angegeben.
Welche Nebenwirkungen hat Enhertu auf die Lunge?
Einige schwere, lebensbedrohliche oder tödliche Fälle von interstitieller Lungenerkrankung (ILD) wurden bei Enhertu Patienten berichtet. Bei Patienten mit mäßiger Nierenfunktionsstörung kann ein höheres Risiko bestehen 6.
Im Rahmen der DESTINY-Lung02-Studie wurde bei 12,9 % der Patienten in der Gruppe mit der niedrigeren Dosis und bei 28 % der Patienten in der Gruppe mit der höheren Dosis eine ILD festgestellt. Die meisten dieser Fälle waren nicht schwerwiegend. Eine ILD des Grades 3 oder höher wurde bei 2 % der Patienten in beiden Patientengruppen festgestellt.
Enhertubei Lungenkrebs ein ähnliches Sicherheitsprofil aufweist wie bei anderen Indikationen. Aufgrund der geringeren Inzidenz unerwünschter Wirkungen (38,6 % gegenüber 58 %) gilt die Dosis von 5,4 mg/kg als optimale Behandlung für NSCLC-Patienten 4.

Wo ist Enhertu für Lungenkrebs zugelassen?
Derzeit ist Enhertu in den USA, der EU, Israel und Japan für die Behandlung erwachsener Patienten mit inoperablem oder metastasiertem nicht-kleinzelligem Lungenkrebs (NSCLC) zugelassen, deren Tumore aktivierende HER2 (ERBB2)-Mutationen aufweisen 4.
Ist Enhertu zur Behandlung von Lungenkrebs in Großbritannien zugelassen?
Ab Juli 2024, noch nicht. In einem vom NICE im März 2024 veröffentlichten endgültigen Leitlinienentwurf wurde angekündigt, dass Enhertu erst dann im NHS erhältlich sein wird, wenn ein kosteneffizienter Preis verfügbar ist. In der Zwischenzeit ist Enhertu im Vereinigten Königreich leider nicht für Lungenkrebs erhältlich . 7.
Kann mein Arzt Enhertu gegen Lungenkrebs verschreiben, wenn es noch nicht zugelassen ist?
Die kurze Antwort lautet: Ja.
Enhertu wurde bereits in mehreren Ländern für die Behandlung von HER2-mutiertem NSCLC zugelassen. Daher ist Ihr Arzt befugt, das Arzneimittel für diese Indikation zu verschreiben, auch wenn es in Ihrem Land noch nicht zugelassen ist.
Wenn ein Arzt ein Medikament zur Behandlung einer Krankheit verschreibt, für die es (noch) nicht zugelassen ist, nennt man das Off-Label-Use. Ein Off-Label-Use-Rezept kann in einigen Ländern schwierig auszustellen sein, je nach den örtlichen Vorschriften und der Verfügbarkeit. Es ist jedoch immer möglich, ein solches Rezept im Rahmen der Named-Patient-Import-Verordnung auszustellen.
Hat Ihr Arzt die Entscheidung getroffen, Enhertu für die Behandlung Ihres Lungenkrebses zu verschreiben? Unser Team auf www.everyone.org kann Ihnen helfen, Zugang zu diesem Medikament zu erhalten. Wir sind auf die Beschaffung und Lieferung von verschriebenen Medikamenten spezialisiert, die im Land des Patienten nicht zugelassen oder nicht erhältlich sind. Kontaktieren Sie uns, damit wir Ihnen helfen können.
Referenzen:
- Stewart, Judith. Enhertu (fam-trastuzumab deruxtecan-nxki) Geschichte der FDA-Zulassung. Drugs.com, 15. August 2022.
- Enhertu. Europäische Arzneimittelagentur, abgerufen am 06. November 2023.
- HER2 und Lungenkrebs. American Lung Association, abgerufen am 6. November 2023.
- Enhertu zeigte in der Phase-II-Studie DESTINY-Lung02 ein starkes und dauerhaftes Ansprechen bei vorbehandeltem fortgeschrittenem Lungenkrebs mit HER2-Mutation. AstraZeneca, 11. September 2023.
- Projektinformationen | Trastuzumab-Deruxtecan zur Behandlung von HER2-mutiertem inoperablem oder metastasiertem nicht-squamösem nicht-kleinzelligem Lungenkrebs nach einer oder mehreren Therapien [ID3934] | Guidance. NICE, abgerufen am 6. November 2023.
- USPI-DB-04 CDX Update FINAL. Daiichi Sankyo Zugriff am 6. November 2023.
- UK NICE lehnt Daiichi Sankyo's Enhertu für Brustkrebs, Pharmaceutical Technology, Zugriff am 15. Juli 2024.