Kann Enhertu Dickdarmkrebs behandeln? Neueste Ergebnisse, Zulassungsfristen und mehr.
Zuletzt aktualisiert: 15. Juli 2024
Sie können legal Zugang zu neuen Arzneimitteln erhalten, auch wenn diese in Ihrem Land nicht zugelassen sind.
Erfahren Sie, wieSeit seiner ersten FDA-Zulassung im Jahr 2019, Enhertu hat in der Welt der Onkologie viel Aufmerksamkeit erregt. Im Jahr 2023 setzt Enhertu seine beeindruckende Entwicklung mit zwei weiteren FDA-Zulassungen für einen Durchbruch fort. Es verfügt nun über insgesamt sieben 1.
Eine der jüngsten Errungenschaften von Enhertu ist die Zulassung als Krebsdiagnose-Therapie. Dies bedeutet, dass es nun bei allen Patienten mit HER2-exprimierenden Tumoren, einschließlich Darmkrebs, eingesetzt werden kann. Für alle Darmkrebspatienten ist dies ein wichtiger Meilenstein. Gleichzeitig wirft es eine Menge Fragen auf.
Hier finden Sie alles, was Sie über Enhertu zur Darmkrebsvorsorge wissen müssen.
Ist Enhertu von der FDA zur Behandlung von Darmkrebs zugelassen?
Ja. Im April 2024 wurde Enhertu für alle Krebsarten zugelassen, bei denen eine HER2-Expression vorhanden ist. Dies schließt auch Darmkrebs ein.
Für welche Arten von Krebs ist Enhertu zugelassen?
Enhertu ist derzeit von der EMA in Europa für die Behandlung von:
- HER2-positiver metastasierender Brustkrebs, der nicht operativ entfernt werden kann;
- HER2-armer metastasierender Brustkrebs, der nicht durch eine Operation entfernt werden kann;
- HER2-positiver fortgeschrittener Magenkrebs (Magenkarzinom) oder Krebs des gastro-ösophagealen Übergangs 4.
In den USA ist Enhertu zusätzlich für die Behandlung von Krankheiten zugelassen:
- Metastasierender nicht-kleinzelliger Lungenkrebs mit HER2-Mutation 5.
- alle HER2-exprimierenden soliden Tumoren.
Wie wirksam ist Enhertu bei Dickdarmkrebs?
Da es sich bei Enhertu um eine zielgerichtete Therapie handelt, ist sie nur bei Krebsarten mit HER-2-Expression anwendbar. Etwa 3-5 % aller Darmkrebserkrankungen fallen unter diese Kategorie 6.
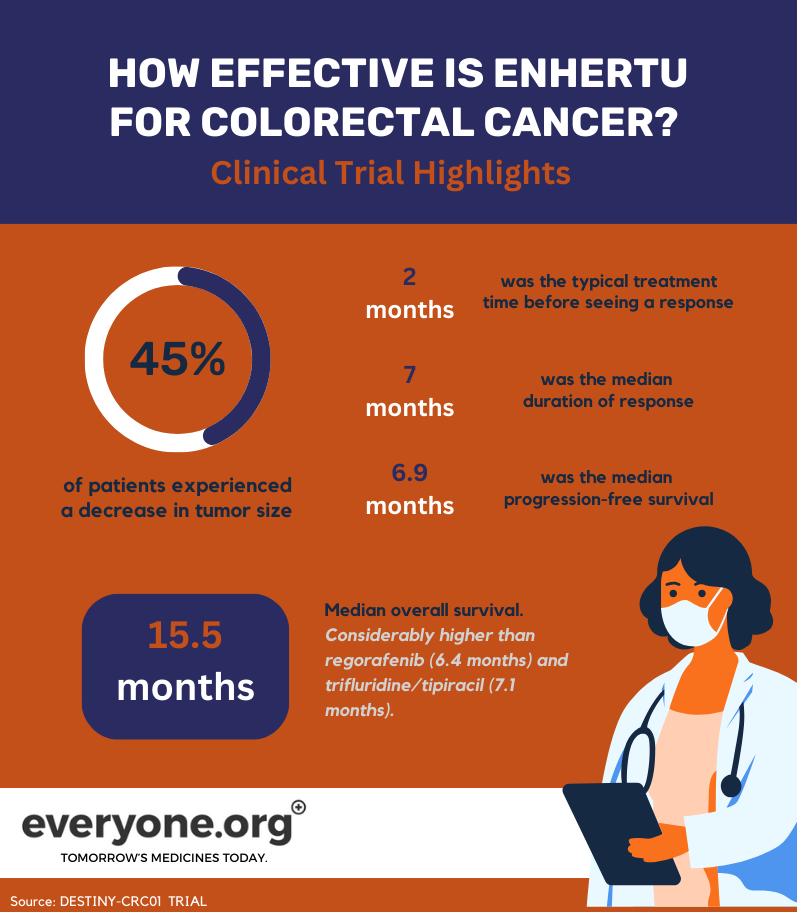
Ergebnisse klinischer Studien
Im Juni 2023 wurden die Endergebnisse der DESTINY-CRC01-Studie veröffentlicht. Diese Phase-2-Studie konzentrierte sich auf die Bewertung der Wirksamkeit und Sicherheit von Enhertu bei Patienten mit HER2-exprimierendem metastasierendem Kolorektalkarzinom. Die an der Studie teilnehmenden Patienten hatten Tumore, die nach mindestens zwei vorherigen Behandlungsrunden fortgeschritten waren 7.
Die wichtigsten Ergebnisse dieser Studie für Darmkrebspatienten waren:
-
Bei 45,3 % der mit Enhertu behandelten Patienten schrumpfte der Tumor teilweise;
-
Das Ansprechen auf die Behandlung wurde in der Regel etwa 2 Monate nach Beginn der Behandlung festgestellt;
-
Die mediane Dauer des Ansprechens betrug 7 Monate;
-
Das mediane progressionsfreie Überleben betrug 6,9 Monate;
-
Das mediane Gesamtüberleben betrug 15,5 Monate. Dieses Ergebnis liegt deutlich über dem derzeitigen Behandlungsstandard. So sind beispielsweise regorafenib und trifluridine/tipiracil gängige Drittlinientherapien. Diese Behandlungen haben ein Gesamtüberleben von 6,4 Monaten bzw. 7,1 Monaten 7.
In einer weiteren Studie mit der Bezeichnung DESTINY-CTC02 wird Enhertu bei Darmkrebspatienten untersucht. Die Studie läuft noch, aber ihre vorläufigen Ergebnisse stimmen mit den Ergebnissen der Studie DESTINY-CTC01 überein 10.

Wie sicher ist Enhertu bei Dickdarmkrebs?
Dies sind die wichtigsten Ergebnisse der DESTINY-CRC01-Studie im Hinblick auf die Sicherheit:
-
Jeder Patient hatte eine Nebenwirkung der Behandlung. Die häufigsten Nebenwirkungen waren Magen- und Blutprobleme.
-
Schwerwiegende unerwünschte Wirkungen traten bei 37,7 % der Patienten auf. Die häufigsten schwerwiegenden Nebenwirkungen waren niedrige Neutrophilenzahlen (22,1 %) und Anämie (14 %) 7.
-
Eine Nebenwirkung, die interstitielle Lungenerkrankung (ILD), war mit dem Absetzen des Medikaments verbunden und wurde bei 7 % der Patienten beobachtet.
-
Es wurden 3 drogenbedingte Todesfälle gemeldet, die alle mit einer interstitiellen Lungenerkrankung zusammenhingen.
Was bedeutet das?
EnhertuDie Sicherheitsergebnisse von können nicht direkt zwischen verschiedenen Patientengruppen verglichen werden. Um Ihnen jedoch zu helfen, die Dinge in den richtigen Kontext zu setzen, finden Sie hier eine Zusammenfassung der Sicherheitsergebnisse von Enhertu für verschiedene Tumorarten. Einschließlich der Tumore, für die Enhertu bereits zugelassen ist:
-
ILD trat bei 12 % der Versuchspatienten auf, mit tödlichem Ausgang in 1,5 % der Fälle;
-
Eine verringerte Neutrophilenzahl trat bei 34,6 % der Studienpatienten auf;
-
Anämie trat bei 34-43 % der Studienpatienten auf (je nach Medikamentendosierung) 8.
In Anbetracht dessen ist das Sicherheitsprofil von Enhertu bei Dickdarmkrebs ähnlich wie bei anderen zugelassenen Krebsarten.
Wann wird Enhertu für die Behandlung von Dickdarmkrebs zugelassen?
Enhertu ist bereits von der FDA für HER2-positiven Darmkrebs zugelassen - eine Indikation, die unter die jüngste FDA-Zulassung von Enhertu fällt.
Diese jüngste Zulassung ist jedoch nur in den USA eine Tatsache. Was bedeutet dies für Darmkrebspatienten in anderen Ländern? Welche Rolle könnte Enhertu bei der Behandlung Ihres Darmkrebses spielen?
Kann mein Arzt Enhertu für Darmkrebs verschreiben?
Die kurze Antwort lautet: Ja.
Enhertu ist bereits von der FDA für die Behandlung von HER2-positivem Dickdarm- und Enddarmkrebs zugelassen. Auch wenn Sie in einem anderen Land leben, ist Ihr Arzt befugt, das Medikament für diese Indikation zu verschreiben. Er könnte dies auf der Grundlage der endgültigen Ergebnisse der DESTINY-CRC01-Studie oder der vorläufigen Ergebnisse der DESTINY-CRC02-Studie und der Besonderheiten Ihres Falls tun.
Wenn ein Arzt Ihnen ein Medikament für eine Krankheit verschreibt, für die es nicht zugelassen ist, handelt es sich um einen Off-Label-Use. In einigen Ländern kann die Einlösung eines Off-Label-Use-Rezepts aufgrund der örtlichen Vorschriften und der Verfügbarkeit schwierig sein. Es ist jedoch immer möglich, ein solches Rezept im Rahmen der Named-Patient-Import-Verordnung auszustellen.
Hat Ihr Arzt die Entscheidung getroffen, Enhertu für die Behandlung Ihres Darmkrebses zu verschreiben? Unser Team auf www.everyone.org kann Ihnen helfen, Zugang zu diesem Medikament zu erhalten. Wir sind auf die Beschaffung und Lieferung von verschriebenen Medikamenten spezialisiert, die im Land des Patienten nicht zugelassen oder nicht erhältlich sind. Kontaktieren Sie uns, damit wir Ihnen helfen können.
Referenzen:
- Barrie, Robert. Enhertu erhält zwei FDA-Zulassungen für bahnbrechende Therapien. Pharmazeutische Technologie, 31. August 2023.
- FDA erteilt Trastuzumab Deruxtecan den Status des Therapiedurchbruchs für HER2+ solide Tumore, einschließlich mCRC. OncLive, 31. August 2023.
- Bahnbrechende Therapie. FDA, 4. Januar 2018.
- Enhertu | Europäische Arzneimittel-Agentur. Europäische Arzneimittel-Agentur, abgerufen am 30. Oktober 2023.
- Stewart, Judith. Enhertu (fam-trastuzumab deruxtecan-nxki) Geschichte der FDA-Zulassung. Drugs.com, 15. August 2022.
- HER2-Biomarker bei Dickdarmkrebs. Kenne deinen Biomarker, 24. Mai 2023.
- Endgültige Ergebnisse von DESTINY-CRC01 zur Untersuchung von Trastuzumab-Deruxtecan bei Patienten mit HER2-exprimierendem metastasierendem Kolorektalkarzinom. Nature Communications, abgerufen am 30. Oktober 2023.
- EnhertuINN-trastuzumab deruxtecan. Europäische Arzneimittelagentur , Zugriff am 30. Oktober 2023.
- Trastuzumab Deruxtecan bei Teilnehmern mit HER2-überexprimierendem fortgeschrittenem oder metastasiertem Darmkrebs (DESTINY-CRC02). ClinicalTrials.gov, abgerufen am 30. Oktober 2023.
- Trastuzumab-Deruxtecan (T-DXd) bei Patienten mit HER2-überexprimierendem/verstärktem (HER2+) metastasierendem Kolorektalkarzinom (mCRC): Primäre Ergebnisse der multizentrischen, randomisierten Phase-2-Studie DESTINY-CRC02. Journal of Clinical Oncology, abgerufen am 30. Oktober 2023.